Saúde
O Sistema Endocanabinóide na Gravidez
Publicado
3 anos atrásem
Por
Soraia Tomás
O Sistema Endocanabinóide (SEC) está envolvido em vários aspectos inerentes à reprodução humana, sendo um elemento importante no desenvolvimento de mecanismos associados à progressão de uma gravidez saudável. A sinalização endocanabinóide está sob um controlo rigoroso, em que qualquer disrupção deste equilíbrio pode ser a causa de uma falha no processo reprodutivo. A canábis contém fitocanabinóides que modulam o SEC e é necessária mais pesquisa focada no impacto que os fitocanabinóides, por meio de sua acção nos receptores de canabinóides, têm na fertilidade, no resultado da gravidez e na saúde fetal.
A Gravidez é o período de gestação dos seres humanos com cerca de nove meses, contados a partir da fecundação e implantação de um óvulo no útero até ao nascimento. Durante a gravidez, o organismo materno passa por diversas alterações fisiológicas que sustentam o bebé em crescimento e o preparam para o parto. Uma gravidez tem início com a fecundação de um óvulo (gâmeta feminino) por um espermatozóide (gâmeta masculino).
Nos seres humanos, a embriogénese, ou período embrionário, tem início com a fecundação e prolonga-se até ao início do período fetal. Após a fecundação, o zigoto desloca-se lentamente ao longo da trompa de Falópio em direção ao útero. Ao longo desta viagem de mais de uma semana, o zigoto divide-se em células idênticas. Esta divisão celular tem início aproximadamente entre 24 a 36 horas após a fecundação. Ao fim do 4º dia de divisão celular, o zigoto dá origem a uma esfera sólida de 16 ou 32 células denominada mórula. Ao chegar ao útero, cinco dias após a fecundação, a mórula sofre alterações e passa a ser denominada de blastocisto. Posteriormente o revestimento de proteínas do blastocisto dissolve-se, o que permite às suas células trofoblásticas entrar em contacto e aderir às células endometriais da parede uterina. O embrião une-se com o endométrio através de um processo denominado nidação, que ocorre oito a dez dias após a ovulação.
Durante a quarta semana de idade gestacional (segunda semana de idade embrionária), as células trofoblásticas que envolvem as células embrionárias penetram profundamente no revestimento uterino, formando a placenta e as membranas embrionárias. Nesta fase, o embrião cresce rapidamente e começam a tomar forma as principais características externas. Este processo, denominado diferenciação celular, produz os diferentes tipos de células do organismo.
O desenvolvimento do embrião tem início com a divisão do óvulo em múltiplas células e é nesta fase que se começam a formar a maior parte dos órgãos, muitos deles funcionais. A partir das oito semanas de idade gestacional, o embrião passa a ser designado feto e apresenta já a forma humana que se desenvolverá continuamente até ao nascimento. O parto ocorre em média cerca de 38 semanas após a fecundação, o que corresponde a aproximadamente 40 semanas após o início do último período menstrual.
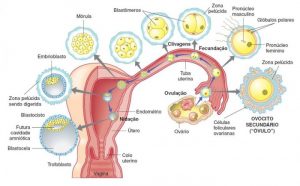
Foto: D.R. | biotadofuturo.com
O Sistema Endocanabinóide e a Gravidez
O sistema Endocanabinóide (SEC) é um sistema endógeno, presente em todos os vertebrados, que está associado a vários processos fisiológicos como a regulação do apetite, energia, imunidade [42] e com a reprodução [27]. Este sistema envolve receptores canabinóides, endocanabinóides e enzimas que sintetizam e metabolizam endocanabinóides.
Os endocanabinóides são lípidos mediadores, derivados de cadeias de ácidos gordos polinsaturados que têm a capacidade de modular vários processos incluindo a reprodução de mamíferos [58]. São sintetizados ‘’on demand’’ a partir de percursores fosfolipídicos que se localizam na membrana plasmática das células [43]. Este metabolismo resulta na produção de dois canabinóides endógenos, a anandamida (AEA) e o 2-araquidonoilglicerol (2-AG). O primeiro alvo da AEA e 2-AG são os receptores canabinóides (CB1 e CB2) [42] expressos nos tecidos periféricos, aos quais se acoplam ativando mecanismos de sinalização intracelular. Além destes últimos a AEA e o 2-AG têm também afinidade para os receptores GPR55, GPR119, receptor ativado por proliferadores de perixoma (PPAR) e receptor de potencial transiente vanilóide 1 (TRPV1).
Ao produzirem o efeito pretendido, os endocanabinóides AEA e 2-AG são degradados por enzimas especificas que incluem a hidrolase da amida de ácidos gordos (FAAH) e a lípase de monoacilglicerol (MAGL) respetivamente, ou por endocitose.
Não apenas os endocanabinóides AEA e 2-AG, mas também outros componentes do SEC são cruciais para o sucesso da fecundação, desenvolvimento do blastocisto, decidualização do endométrio, desenvolvimento placentário e implantação do embrião.
O Sistema Endocanabinóide e o Sistema Reprodutor
O SEC é expresso no útero [37], ovários, oviduto, folículos, endométrio [29], esperma e testículos [36], com localizações celulares especificas e mudanças na sua expressão em resposta a uma gravidez.
A expressão do SEC tanto no sistema reprodutor feminino como no masculino (p.e. Células de Leydig*) comprova o seu envolvimento em processos fisiológicos vitais como a espermatogénese, foliculogénese e a maturação oocitária. [28][35]
*Células de Leydig – células que se localizam nos túbulos seminíferos, responsáveis pela produção de testosterona quando estimuladas pela hormona luteinizante (LH).
Existe evidência científica que sustenta a hipótese da regulação do SEC por hormonas sexuais [26] propondo que os componentes do SEC são expressos sob controlo hormonal tanto nos ovários como no folículo em desenvolvimento, no corpo lúteo e no corpo albican. [28]
Os níveis plasmáticos de AEA, FAAH e progesterona sofrem variações ao longo do ciclo menstrual [13][20][22][23]. Está comprovado que a progesterona, produzida pelo corpo lúteo, modula o SEC ao potenciar a atividade da FAAH que se traduz na diminuição da concentração de AEA. [29][23][31][32]
O estrogénio, produzido pelo folículo ovário durante o ciclo menstrual, acopla-se a receptores específicos de estrogénio, resultando na regulação de inúmeros mecanismos de sinalização envolvidos na proliferação celular, apoptose e autofagia [46]. Maia et al., sugere que o estrogénio modula a AEA e receptores canabinóides tanto na glândula uterina como no lúmen das células epiteliais .[28]
Ovários
O primeiro estudo da localização do SEC nos ovários foi desenvolvido em 2009 por El-Talatina e colegas [11]. Este estudo revelou a expressão de receptores canabinóides, AEA, 2‐AG, FAAH e MAGL na medula e córtex do ovário, predominantemente nas células granulosas dos folículos, nas células de Teca**, nos folículos secundário e terciário, no corpo lúteo e posteriormente no corpo Albican [29].
**Células Teca – células somáticas presentes no folículo em desenvolvimento que se situam externamente à camada de células da granulosa. Quando ocorre ativação dos folículos, na fase secundária do desenvolvimento, as células de Teca são recrutadas para se diferenciaram. Quando ativas, estas células produzem androgénios que têm um papel crucial durante a maturação folicular e protegem folículo em desenvolvimento, dando suporte estrutural e vascular até á ovulação.
Trompas de Falópio
Estudos pré-clinicos sugerem que a AEA, ao ativar os receptores CB1 promove o transporte oviductal adequado dos espermatozoides através da trompa de Falópio. Ao atingirem o óvulo, os espermatozoides são expostos a concentrações progressivamente menores de AEA, ideais para a fecundação e suficientes para a ativação do receptor TRPV1. [7]
Vários autores suportam a hipótese de que a regulação da síntese de endocanabinóides é um requisito para um desenvolvimento pré-embrionário bem-sucedido. Nestes estudos foi detetada a expressão do receptor CB1 no primeiro estadio de duas células embrionárias até ao desenvolvimento do blastocisto. Em estadios posteriores, esta expressão é restricta ao trofectoderma [38][59][55]
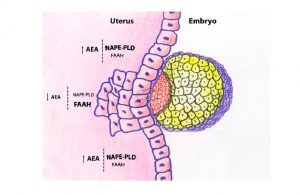
As concentrações de endocanabinóides contribuem para a criação de um ambiente apropriado ao transporte do embrião do ovário ao útero, onde será implantado. Na verdade, foi detetada uma maior concentração de FAAH na ampola e de NAPE-PLD no istmo. Este diferencial de expressão é responsável pela manutenção dos níveis adequados de AEA durante o transporte oviductal. [7]
Útero
O Sistema Endocanabinóide desempenha um papel fundamental no útero [37], influenciando a sua receptividade, o desenvolvimento da placenta e a implantação embrionária [3][12][21][30][33][44][48]
O útero sofre alterações morfológicas e fisiológicas durante a gravidez para garantir o sucesso da mesma, sendo a apoptose e a necrose secundária mecanismos importantes envolvidos na regressão das células placentárias. [53][56] [61]
De forma a ser bem-sucedida, a implantação embrionária depende de uma interação precisa entre o endométrio e o blastocisto a ser implantado. Inicialmente requer um ambiente uterino receptivo e posteriormente um blastocisto ativo, capaz de chegar ao útero e ser implantado. [36][41][57] Este processo ocorre 6 a 7 dias após a fertilização e para que o mesmo se inicie é necessário um blastocisto que seja capaz de emergir da zona pelúcida, expondo desta forma o trofoblasto, seguindo-se a sua entrada no endométrio e finalmente a sua invasão [36].
Receptividade do útero
Estudos pré-clinicos sugerem que a receptividade do útero é crucialmente influenciada pela atividade da AEA, da FAAH e do factor inibitório de leucemia (LIF) membro da família IL-6 que afeta o crescimento celular inibindo a diferenciação celular. [9][18][48][49][57]
Implantação Embrionária
Concentrações reduzidas de AEA e elevadas de FAAH são detectadas no momento de implantação, quando comparadas a outros locais no mesmo período, que apresentam níveis muito mais elevados de AEA e baixos de FAAH.
Esta afirmação é comparada por estudos pré-clínicos onde o embrião foi submetido a elevados níveis de anandamida no útero provocando intoxicação do mesmo, diminuição da proliferação das células trofoblásticas e consequente falha na implantação. [39][54]59]
C. Fernand et al. Endocannabinoid system and pregnancy. Reproduction (2016)
Estudos realizados em mulheres submetidas a fertilização in-vitro, em quem é possível identificar de forma precisa o momento de implantação bem como acompanhar o desenvolvimento embrionário, demonstraram que inicialmente se observa um aumento (por um curto período) dos níveis plasmáticos de anandamida (provavelmente para ajudar o blastocisto a eclodir) seguida de uma abrupta redução desses mesmo níveis (para prevenir a apoptose das células trofoblásticas garantindo desta forma a fixação adequada do blastocisto e um desenvolvimento embrionário favorável [12]. Para que a implantação embrionária seja bem-sucedida são necessários níveis baixos de AEA (e consequentes níveis elevados de FAAH), que se acopla ao receptor CB1, ativando a via de sinalização ERK. Em baixas concentrações, a anandamida é capaz de ativar a sinalização de ERK e promover o crescimento do blastocisto, em concentrações elevadas inibe a mobilização de cálcio. [55].
É necessário um equilíbrio critico dos níveis de endocanabinóides para que a gravidez se desenvolva com sucesso, garantindo o desenvolvimento adequado das células trofoblásticas e implantação embrionária. [12] A AEA modula a síntese de COX-2, mediadores inflamatórios que aumentam a permeabilidade vascular e angiogénese que antecede a implantação embrionária. [4][16]
C. Fernand et al. Endocannabinoid system and pregnancy. Reproduction (2016)
Desenvolvimento da Placenta
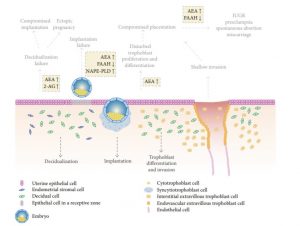
O desenvolvimento da placenta compreende processos rigidamente controlados de proliferação, diferenciação e apoptose das células trofoblásticas pela interação de hormonas, fatores de crescimento e outros mediadores de sinalização. O SEC desempenha um papel fundamental nos mecanismos subjacentes ao desenvolvimento da placenta sendo que uma desregulação deste equilíbrio está associada a alterações na progressão de uma gravidez saudável. [2]
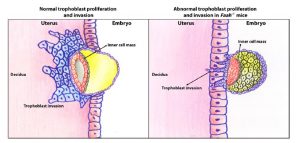
O desenvolvimento normal da placenta depende da diferenciação e invasão do trofoblasto, o principal componente celular da placenta que tem origem no trofoectoderma do blastocisto no início da gravidez. Durante esse processo de desenvolvimento e invasão, as células trofoblásticas multiplicam-se para formar a interface entre o corpo materno e o embrião. As células trofoblásticas invadem a decídua para que as artérias uterinas se desenvolvam de forma favorável, permitindo a expansão dos tecidos extra-embrionários e o aumento do fluxo sanguíneo para a placenta e feto em desenvolvimento. Qualquer perturbação desse processo, que é rigidamente regulado e influenciado por vários fatores, pode levar a complicações na gravidez. [49]
Os endocanabinóides, AEA e 2-AG modulam a rede de citoquinas e hormonas presentes nos mecanismos inerentes ao desenvolvimento da placenta. [1][2][52] Paria et al. sugerem que as células do trofoblasto expostas a baixos níveis de endocanabinóides crescem e diferenciam-se mais rapidamente [38][39][40][41] sendo que estes efeitos são mediados pelos receptores CB1.
Estudos comprovam que os receptores canabinóides e a AEA são expressos nas células deciduais [16][5] – células especializadas da placenta que incluem o trofoblasto, o citotrofoblasto e o sinciciotrofoblasto. [47][19]
A AEA provoca disrupção do processo de decidualização em culturas primárias de células endometriais de ratos, sugerindo a incompatibilidade de elevadas concentrações de AEA e o sucesso da implantação e da sobrevivência do blastocisto. [16]
Além disso, o papel inibitório da AEA no processo de decidualização demonstrou diminuir a atividade da CYP19A1, gene responsável pela codificação da aromatase, enzima envolvida no processo de conversão do androgénio em estrogénio [8] e prejudicar a secreção da gonadotrofina coriónica humana pelo sinciciotrofoblasto. [8]
Estudos demonstram ainda que a alteração do metabolismo da AEA afeta a diferenciação celular e induz o bloqueio do ciclo celular na fase G2/M, assim como altera os marcadores de prolactina (PRL) e do factor de crescimento (IGFBP1) de forma dependente do receptor CB1 nas células do estroma endotelial e nas culturas primárias de células do fibroblasto decidual (HdF) derivado da placenta. [1]
A exposição fetal a substâncias tóxicas pode levar a alterações do desenvolvimento, malformações congénitas e parto prematuro. A placenta protege o feto da exposição a essas substâncias recorrendo a transportadores xenobióticos de efluxo que evitam a invasão por parte desses tóxicos. A proteína de resistência ao cancro da mama (BCRP / ABCG2) é um desses transportadores de efluxo que, na placenta, limita a exposição do feto a certos tóxicos. [47]
Os sinciciotrofoblastos surgem da fusão dos citotrofoblastos, um processo regulado pela AEA, que através do receptor CB2 (mediado pelo cAMP), modula também a atividade do transportador de efluxo BCRP / ABCG2 expresso na membrana dos sincitiotrofoblastos placentários, protegendo desta forma o feto da exposição a componentes tóxicos. [47]
O endocanabinóide 2-AG revelou ser também um importante interveniente no desenvolvimento da placenta, induzindo a apoptose de células do citotrofoblasto através a ativação do receptor CB2. A presença de duas enzimas-chave envolvidas na biossíntese e degradação de 2-AG, DAGLA e MAGL, em células de citotrofoblasto, permite uma regulação adequada dos níveis de 2-AG in situ. [7][2]
Fonseca, B. M. et al. (2013). The Endocannabinoid System in the Postimplantation Period: A Role during Decidualization and Placentation. International
Parto
O amadurecimento do colo do útero é um pré-requisito para o trabalho de parto normal o, durante o qual o colo do útero não flexível deve ficar menos rígido e dilatar. Isso implica uma remodelação dramática da matriz extracelular. Estudos sugerem a presença do receptor TRPV1 na remodelação da matriz extracelular que ocorre no colo do útero momentos antes do parto. Foram detetadas fibras nervosas TRPV1-IR durante o amadurecimento do colo do útero, indicando a sua função chave na nocicepção inerente aos mecanismos de dor associados ao parto. [63]
As prostaglandinas são moléculas lipídicas que desempenham um papel fundamental nos mecanismos associados ao início do parto, estando implicadas na regulação de contrações uterinas, amadurecimento cervical e ruptura da membrana. Um estudo realizado por Mitchell et al. em 2008 sugere que elevadas concentrações de AEA aumentam a produção de prostaglandinas estimulando as contrações uterinas associadas ao início do trabalho de parto. [33]
Foram também quantificados os níveis de AEA durante uma gravidez e conclui-se que as concentrações deste componente eram mais baixas no primeiro trimestre (de forma semelhante aos níveis avaliados durante a fase lútea do ciclo menstrual) mantendo-se esses valores até ao início do terceiro trimestre, altura em que começavam a aumentar. No início do parto esses valores são 2 a 4 vezes mais elevados do que no primeiro trimestre. [20][22][34]
Um estudo pré-clínico realizado em ratos demonstrou que a expressão dos receptores CB1, CB2 e TRPV1 varia no tecido da decídua (formada a partir da camada do endométrio que recobre o blastocisto após ocorrer a nidação – processo de fixação à parede uterina) de acordo com um padrão previsível. [14] Simultaneamente, os níveis de AEA e PEA aumentam em dois momentos específicos da gravidez, no 10ª e 19º dia, altura em que se dá início à preparação para o parto. Estas observações indicam-nos que o sistema endocanabinóide está intrinsecamente interligado não apenas com o desenvolvimento adequado da gravidez, mas também com o momento de preparação para o parto. [14]
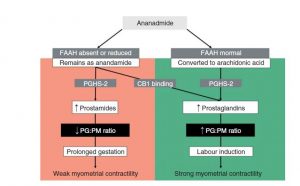
C. Hsiu-Wen et al. The role of endocannabinoids in pregnancy (2013)
A canábis e a Gravidez
A canábis contém fitocanabinóides que modulam o Sistema Endocanabinóide e é necessária a realização de mais pesquisa focada no impacto que os fitocanabinóides, por meio de sua ação nos receptores de canabinóides, têm na fertilidade, no resultado da gravidez e na saúde fetal. A alteração na expressão dos receptores canabinóides ou na homeostase dos endocanabinóides pela ingestão excessiva de canábis durante a gravidez está associada a resultados negativos da gravidez incluindo partos prematuro, abortos espontâneos, ruptura da placenta, bebés com baixo peso à nascença. Segundo alguns autores é observado um aumento da taxa de infertilidade masculina e feminina [60] em utilizadores de canábis, enquanto que outros contradizem esta afirmação. [62].
Em 2020, uma revisão sistemática levada a cabo por investigadores da Columbia University, do New York State Psychiatric Institute e da Swinburne University sugere que não são encontradas diferenças estatisticamente significativas em crianças expostas a canábis durante a gravidez concluindo que a exposição pré-natal à planta canábis não está associada a um défice cognitivo nestas crianças. [64]
Neste documento debruçamo-nos sobre o importante papel que o sistema endocanabinóide desempenha na progressão da gravidez e não no potencial terapêutico da planta canábis. Por questões éticas, não são realizados ensaios clínicos desta natureza em grávidas, pelo que a terapia com canabinóides reserva-se a situações em que o os benefícios se sobrepõem aos riscos associados à sua utilização, como hiperemesis gravídica e o alívio de outros sintomas em que a utilização de outros medicamentos (com potenciais efeitos adversos) estivesse indicada.
De outra forma não é recomendada a utilização de canabinóides durante a gravidez.

Foto D.R.| the-scientist
Conclusão
O sistema endocanabinóide (SEC) está envolvido em vários aspectos inerentes à reprodução humana sendo um elemento importante no desenvolvimento de mecanismos associados à progressão de uma gravidez saudável. O endocanabinóide 2-AG está envolvido no desenvolvimento dos primeiros estadios da célula embrionária pela ativação dos receptores CB2 enquanto que os níveis de AEA são tendencionalmente baixos até ao momento do parto, altura em que aumentam drasticamente. A enzima FAAH desempenha um papel fundamental na modulação do SEC durante a gravidez. Até ao momento a investigação científica comprova a importância deste sistema na regulação da fertilização através da ativação de espermatozoides, amadurecimento do ovócito, a eclosão do embrião, a maturação do óvulo, transporte pelo oviduto, implantação embrionária, desenvolvimento da placenta, manutenção da gravidez e trabalho de parto.
A sinalização endocanabinóide está sob um controlo rigoroso em que qualquer disrupção deste equilíbrio pode ser a causa de uma falha no processo reprodutivo. Com um aumento do consumo adulto de canábis em vários países, é importante perceber as consequências na fertilidade masculina/feminina e no decorrer da gravidez. O potencial terapêutico desta planta tão versátil está reservado a situações em que os benefícios da sua utilização sobrepõem os riscos inerentes a uma gravidez bem-sucedida. O acompanhamento médico é crucial para que o tratamento com canabinóides seja seguro e eficaz.
Bibliografia:
- Almada M, Amaral C, Diniz‐da‐Costa M, Correia‐da‐Silva G, Teixeira NA, and Fonseca BM. The endocannabinoid anandamide impairs in vitro decidualization of human cells. Reproduction 152: 351‐361, 2016.
- Almada M, Costa L, Fonseca B, Alves P, Braga J, Gonçalves D, Teixeira N, and Correia‐da‐Silva G. The endocannabinoid 2‐arachidonoylglycerol promotes endoplasmic reticulum stress in placental cells. Reproduction 160: 171‐180, 2020.
- Battista N, Bari M, Rapino C, Trasatti F, D’Agostino A, Maccarrone M. Regulation of female fertility by the endocannabinoid system. Hum Fertil 2007;10:207–16.
- Bariani MV, Domínguez Rubio AP, Cella M, Burdet J, Franchi AM, and Aisemberg J. Role of the endocannabinoid system in the mechanisms involved in the LPS‐induced preterm labor. Reproduction 150: 463‐472, 2015.
- Brocato B, Zoerner AA, Janjetovic Z, Skobowiat C, Gupta S, Moore BM, 2nd, Slominski A, Zhang J, Schenone M, Phinehas R, Ferry RJ, Jr., Dick E, Jr., Hubbard GB, Mari G, and Schlabritz‐Loutsevitch N. Endocannabinoid crosstalk between placenta and maternal fat in a baboon model (Papio spp.) of obesity. Placenta 34: 983‐989, 2013.
- Brown AJ. Novel cannabinoid receptors. Br J Pharmacol 152: 567‐575, 2007.
- Costa MA, Fonseca BM, Keating E, Teixeira NA, and Correia‐da‐Silva G. 2‐arachidonoylglycerol effects in cytotrophoblasts: metabolic enzymes expression and apoptosis in BeWo cells. Reproduction 147: 301‐311, 2014.
- Costa MA, Keating E, Fonseca BM, Teixeira NA, and Correia‐da‐Silva G. 2‐Arachidonoylglycerol impairs human cytotrophoblast cells syncytialization: influence of endocannabinoid signalling in placental development. Mol Cell Endocrinol 399: 386‐394, 2015.
- Cui N, Wang C, Zhao Z, Zhang J, Xu Y, Yang Y, and Hao G. The Roles of Anandamide, Fatty Acid Amide Hydrolase, and Leukemia Inhibitory Factor on the Endometrium during the Implantation Window. Front Endocrinol 8: 268, 2017. Endocannabinoids in early pregnancy
- Domenico E, Todaro 306 F, Rossi G, Dolci S, Geremia R, Rossi P, and Grimaldi P. Overactive type 2 cannabinoid receptor induces meiosis in fetal gonads and impairs ovarian reserve. Cell Death Dis 8: e3085, 2017.
- El‐Talatini MR, Taylor AH, Elson JC, Brown L, Davidson AC, and Konje JC. Localisation and function of the endocannabinoid system in the human ovary. PLoS One 4: e4579, 2009.
- El-Talatini MR, Taylor AH, Konje JC. Fluctuation in anandamide levels from ovulation to early pregnancy in in-vitro fertilization-embryo transfer women, and its hormonal regulation. Hum Reprod 2009;24:1989–98.
- El-Talatini MR, Taylor AH, Konje JC. The relationship between plasma levels of the endocannabinoid, anandamide, sex steroids, and gonadotrophins during the menstrual cycle. Fertil Steril 2009; In Press, doi:10.1016/j.fertnStert.1008.12.033.
- Fonseca BM, Correia-da-Silva G, Taylor AH, Konje JC, Bell SC, Teixeira NA. Spatiotemporal expression patterns of anandamide-binding receptors in rat implantation sites: evidence for a role of the endocannabinoid system during the period of placental development. Am J Obstet Gynecol 2009;7:121.
- Fonseca BM, Correia-da-Silva G, Teixeira NA. Anandamide-induced cell death: dual effects in primary rat decidual cell cultures. Placenta 2009;30:686–92.
- Fonseca BM, Correia‐da‐Silva G, and Teixeira NA. Anandamide restricts uterine stromal differentiation and is critical for complete decidualization. Mol Cell Endocrinol 411: 167‐176, 2015.
- Garcia‐Arencibia M, Molina‐Holgado E, and Molina‐Holgado F. Effect of endocannabinoid signalling on cell fate: life, death, differentiation and proliferation of brain cells. Br J Pharmacol 176:1361‐1369, 2019.
- Habayeb OM, Bell SC, Konje JC. Endogenous cannabinoids: metabolism and their role in reproduction. Life Sci 2002;70:1963–77.
- Habayeb OM, Taylor AH, Bell SC, Taylor DJ, and Konje JC. Expression of the endocannabinoid system in human first trimester placenta and its role in trophoblast proliferation. Endocrinol 149: 5052‐5060, 2008.
- Habayeb OM, Taylor AH, Evans MD, et al. Plasma levels of the endocannabinoid anandamide in women — a potential role in pregnancy maintenance and labor? J Clin Endocrinol Metab 2004;89:5482–7.
- Horne AW, Phillips 3rd JA, Kane N, et al. CB1 expression is attenuated in Fallopian tube and decidua of women with ectopic pregnancy. PLoS One 2008;3:e3969.
- Lam PM, Marczylo TH, El-Talatini M, et al. Ultra performance liquid chromatography tandem mass spectrometry method for the measurement of anandamide in human plasma. Anal Biochem 2008;380:195–201.
- Lazzarin N, Valensise H, Bari M, et al. Fluctuations of fatty acid amide hydrolase and anandamide levels during the human ovulatory cycle. Gynecol Endocrinol 2004;18:212–8.
- Li Y, Bian F, Sun X, and Dey SK. Mice Missing Cnr1 and Cnr2 Show Implantation Defects. Endocrinol 160: 938‐946, 2019.
- López‐Cardona AP, Pérez‐Cerezales S, Fernández‐González R, Laguna‐Barraza R, Pericuesta E,Agirregoitia N, Gutiérrez‐Adán A, and Agirregoitia E. CB(1) cannabinoid receptor drives oocyte maturation and embryo development via PI3K/Akt and MAPK pathways. FASEB J 31: 3372‐3382, 2017.
- MacCarrone M, De Felici M, Bari M, Klinger F, Siracusa G, and Finazzi‐Agrò A. Down‐regulation of anandamide hydrolase in mouse uterus by sex hormones. Euro J Biochem 267: 2991‐2997, 2000.
- Maccarrone M, Valensise H, Bari M, Lazzarin N, Romanini C, and Finazzi‐Agrò A. Progesterone up‐regulates anandamide hydrolase in human lymphocytes: role of cytokines and implications for J Immunol 166: 7183‐7189, 2001.
- Maia J, Almada M, Silva A, Correia‐da‐Silva G, Teixeira N, Sá SI, and Fonseca BM. The endocannabinoid system expression in the female reproductive tract is modulated by estrogen. J Steroid Biochem Mole Biol 174: 40‐47, 2017. Endocannabinoids in early pregnancy
- Maia J, Fonseca BM, Teixeira N, and Correia‐da‐Silva G. The fundamental role of the endocannabinoid system in endometrium and placenta: implications in pathophysiological aspects of uterine and pregnancy disorders. Human Reprod Update 26: 586‐602, 2020.
- Maccarrone M. Endocannabinoids: friends and foes of reproduction. Prog Lipid Res 2009;48:344–54.
- Maccarrone M, Bari M, Di Rienzo M, Finazzi-Agro A, Rossi A. Progesterone activates fatty acid amide hydrolase (FAAH) promoter in human T lymphocytes through the transcription factor Ikaros. Evidence for a synergistic effect of leptin. J Biol Chem 2003;278:32726–32.
- Maccarrone M, Valensise H, Bari M, Lazzarin N, Romanini C, Finazzi-Agro A. Progesterone up-regulates anandamide hydrolase in human lymphocytes: role of cytokines and implications for fertility. J Immunol 2001;166:7183–9.
- Mitchell MD, Sato TA, Wang A, Keelan JA, Ponnampalam AP, Glass M.Cannabinoids stimulate prostaglandin production by human gestational tissues through a tissue- and CB1-receptor-specific mechanism. Am J Physiol Endocrinol Metab 2008;294:E352–6.
- Nallendran V, Lam PM, McParland PC, Taylor AH, Konje JC. Prediction of preterm labour among asymptomatic high risk patients using plasma anandamide levels. Reprod Sci 2009;16:220ª
- Nielsen JE, Rolland AD, Rajpert‐De Meyts E, Janfelt C, Jørgensen A, Winge SB, Kristensen DM, Juul A, Chalmel F, Jégou B, and Skakkebaek NE. Characterisation and localisation of the endocannabinoid system components in the adult human testis. Sci Rep 9: 12866, 2019.
- Norwitz ER, Schust DJ, Fisher SJ. Implantation and the survival of early pregnancy. New Engl J Med 2001;345:1400–8.
- Pagano E, Orlando P, Finizio S, Rossi A, Buono L, Iannotti FA, Piscitelli F, Izzo AA, Di Marzo V, and Borrelli F. Role of the endocannabinoid system in the control of mouse myometrium contractility during the menstrual cycle. Biochem Pharmacol 124: 83‐93, 2017.
- Paria BC, Das SK & Dey SK 1995 The preimplantation mouse embryo is a target for cannabinoid ligand-receptor signaling. PNAS 92 9460–9464. (doi:10.1073/pnas.92.21.9460)
- Paria BC, Dey SK. Ligand-receptor signaling with endocannabinoids in preimplantation embryo development and implantation. Chem Phys Lipids 2000;108: 211–20.
- Paria BC, Ma W, Andrenyak DM, et al. Effects of cannabinoids on preimplantation mouse embryo development and implantation are mediated by brain-type cannabinoid receptors. Biol Reprod 1998;58:1490–5.
- Paria BC, Wang H, Dey SK. Endocannabinoid signaling in synchronizing embryo development and uterine receptivity for implantation. Chem Phys Lipids 2002;121:201–10.
- Pertwee RG. Endocannabinoids and Their Pharmacological Actions. Handb Exp Pharmacol 231: 1‐37, 2015.
- Piomelli D, Giuffrida A, Calignano A, and Rodríguez de Fonseca F. The endocannabinoid system as a target for therapeutic drugs. Trends Pharmacol Sci 21: 218‐224, 2000.
- Ribeiro ML, Vercelli CA, Sordelli MS, et al. 17beta-oestradiol and progesterone regulate anandamide synthesis in the rat uterus. Reprod Biomed Online 2009;18: 209–18.
- Schmid PC, Paria BC, Krebsbach RJ, Schmid HH, Dey SK. Changes in anandamide levels in mouse uterus are associated with uterine receptivity for embryo implantation. Proc Natl Acad Sci USA 1997;94:4188–92.
- Shrivastava A, Kuzontkoski PM, Groopman JE, and Prasad A. Cannabidiol induces programmed cell death in breast cancer cells by coordinating the cross‐talk between apoptosis and autophagy. Mol Cancer Therapeut 10: 1161‐1172, 2011.
- Szilagyi JT, Composto‐Wahler GM, Joseph LB, Wang B, Rosen T, Laskin JD, and Aleksunes LM. Anandamide down‐regulates placental transporter expression through CB2 receptor‐mediated inhibition of cAMP synthesis. Pharmacol Res 141: 331‐342, 2019.
- Sun X, Dey SK. Aspects of endocannabinoid signaling in periimplantation biology. Mol Cell Endocrinol 2008;286:S3–S11.
- Taylor AH, Ang C, Bell SC, Konje JC. The role of the endocannabinoid system in gametogenesis, implantation and early pregnancy. Hum Reprod Update 2007;13: 501–13.
- Trabucco E, Acone G, Marenna A, et al. Endocannabinoid system in first trimester placenta: low FAAH and high CB1 expression characterize spontaneous miscarriage. Placenta 2009;30:516–22.
- Tranguch S,Daikoku T,Guo Y,Wang H,Dey SK.Molecular complexity inestablishing uterine receptivity and implantation. Cell Mol Life Sci 2005;62:1964–73
- Vaswani K, Chan HW, Peiris HN, Nitert MD, Bradley RJ, Armitage JA, Rice GE, and Mitchell MD. Gestation Related Gene Expression of the Endocannabinoid Pathway in Rat Placenta. Med Inflamm 2015: 850471, 2015.
- Vercelli CA, Aisemberg J, Billi S, Wolfson ML, Franchi AM. Endocannabinoid system and nitric oxide are involved in the deleterious effects of lipopolysaccharide on murine decidua. Placenta 2009;30:579–84.
- Wang H, Dey SK. Lipid signaling in embryo implantation. Prostaglandins Other Lipid Mediat 2005;77:84–102.
- Wang H, Matsumoto H, Guo Y, Paria BC, Roberts RL, Dey SK. Differential G protein-coupled cannabinoid receptor signaling by anandamide directs blastocyst activation for implantation. Proc Natl Acad Sci USA 2003;100:14914–9.(doi:10.1073/pnas.2436379100)
- Wang H, Xie H, Sun X, et al. Differential regulation of endocannabinoid synthesis and degradation in the uterus during embryo implantation. Prostaglandins Other Lipid Mediat 2007;83:62–74.
- Wang H, Dey SK, Maccarrone M. Jekyll and hyde: two faces of cannabinoid signaling in male and female fertility. Endocr Rev 2006;27:427–48.
- Wolfson ML, Muzzio DO, Ehrhardt J, Franchi AM, Zygmunt M, and Jensen F. Expression analysis of cannabinoid receptors 1 and 2 in B cells during pregnancy and their role on cytokine production. J Reprod Immunol 116: 23‐27, 2016.
- Yang ZM, Paria BC, Dey SK. 1996 Activation of brain-type cannabinoid receptors interferes with preimplantation mouse embryo development. Biol Reprod 1996;55:756–61. doi:10.1095/biolreprod55.4.756
- Zuckerman B, Frank DA, Hingson R, et al. Effects of maternal marijuana and cocaine use on fetal growth. N Engl J Med 1989;320:762–8.
- López-Cardona, I. Ibarra-Lecue, R. Laguna-Barraza, S. Pérez-Cerezales, L.Urigüen, N. Agirregoitia, A. Gutierrez-Adán, E. Agirregoitia, Effect of chronic THC administration in the reproductive organs of male mice, spermatozoa and in vitro fertilization, Biochemical Pharmacology (2018), doi: https://doi.org/10.1016/j.bcp.2018.07.045
- Hsiu-Wen et al. The role of endocannabinoids in pregnancy – Reproduction (2013) 146 R101–R109 https://doi.org/10.1530/REP-12-0508
- Tingaker B.K., Ekman-Ordeberg G., Facer P., Irestedt L., Anand P. Influence of pregnancy and labor on the occurrence of nerve fibers expressing the capsaicin receptor TRPV1 in human corpus and cervix uteri. Reprod. Biol. Endocrinol. 2008;6:8. doi: 10.1186/1477-7827-6
- Torres CA, Medina-Kirchner C, O’Malley KY e Hart CL (2020) A totalidade das evidências sugere que a exposição pré-natal à cannabis não leva a deficiências cognitivas: uma revisão sistemática e crítica. Frente. Psychol. 11: 816. doi: 10.3389 / fpsyg.2020.00816
__________________________________________________________________*Soraia Tomás é Enfermeira, licenciada pela Escola Superior de Enfermagem de Coimbra em 2015. Desempenhou funções nos cuidados intensivos de cirurgia Cardio-Torácica e transplantação pulmonar em Lisboa. Neste momento trabalha no Spine Center, serviço de cirurgia à coluna e unidade de cuidados intensivos de cirurgia geral no Hospital da Luz em Coimbra, cidade onde reside. Entusiasta na área da Canábis Medicinal, é membro do conselho científico do Observatório Português de Canábis Medicinal, esteve presente em conferências neste âmbito (Portugal Medical Cannabis, Cannabis Europa, CannX, entre outras) e obteve uma pós-graduação em GMP’s para Canábis Medicinal, curso realizado pelo Observatório Português de Canábis Medicinal em parceria com o Laboratório Militar de Produtos Químicos e Farmacêuticos e a Faculdade de Farmácia da Universidade de Lisboa. Presidente da Direcção da apcanna – Associação Portuguesa de Informação sobre Canábis, pretende desenvolver projetos dedicados à divulgação, educação e formação em canábis medicinal a profissionais de saúde e ao público em geral, promovendo desta forma a excelência na prática profissional e o acesso seguro e eficaz a terapias com canabinóides.
____________________________________________________________________________________________________
[Aviso: Por favor, tenha em atenção que este texto foi originalmente escrito em Português e é traduzido para inglês e outros idiomas através de um tradutor automático. Algumas palavras podem diferir do original e podem verificar-se gralhas ou erros noutras línguas.]____________________________________________________________________________________________________

O que fazes com 3€ por mês? Torna-te um dos nossos Patronos! Se acreditas que o Jornalismo independente sobre canábis é necessário, subscreve um dos níveis da nossa conta no Patreon e terás acesso a brindes únicos e conteúdos exclusivos. Se formos muitos, com pouco fazemos a diferença!
Notícias Relacionadas
-


Uber entra no mega-negócio da Canábis no Canadá
-


Portugal: O futuro do cânhamo industrial discute-se amanhã em Beja
-


Portugal: Primeiro Ministro, António Costa, demite-se por suspeitas de corrupção
-
Reino Unido: Epidyolex disponível para pacientes com Esclerose Tuberculosa
-


CT-CANN23: Michael Barnes diz que pacientes do Reino Unido não conseguem suportar financeiramente tratamentos com canábis
-


Zurique avança com projecto piloto para o uso adulto de canábis

Mais recentes


O 4:20 está a chegar e há celebrações no Porto e em Lisboa
A data da celebração da cultura da canábis está a chegar! Este sábado, 20 de Abril, é o dia em...


Paul Bergholts, alegado líder da Juicy Fields, detido na República Dominicana
Paul Bergholts, o alegado líder do esquema em pirâmide Juicy Fields, terá sido detido na República Dominicana e será submetido a...


Canabinóides revelam resultados promissores no tratamento do Transtorno da Personalidade Borderline
Uma investigação levada a cabo pela Khiron LifeSciences e coordenada por Guillermo Moreno Sanz sugere que os medicamentos à base de...


Caso Juicy Fields: 9 detidos pela Europol e Eurojustice. Burla ultrapassa 645 milhões de euros
Uma investigação conjunta conduzida por várias autoridades europeias, apoiadas pela Europol e pela Eurojust, culminou na detenção de nove suspeitos...


Utilizadores regulares de canábis podem necessitar de mais anestesia durante procedimentos médicos
Os utilizadores regulares de canábis podem necessitar de mais anestesia durante os procedimentos médicos para permanecerem sedados, se comparados com...


O futuro do CBD no Japão: Como as reformas legais irão moldar o mercado
No final do ano passado, o Japão deu um grande passo em direcção à reforma da canábis depois de aprovar...


Portugal: GreenBe Pharma obtém certificação EuGMP nas instalações de Elvas
A GreenBe Pharma, uma empresa de canábis medicinal localizada em Elvas, Portugal, obteve a certificação EU-GMP, ao abrigo dos regulamentos...


Álvaro Covões, da Everything is New, compra instalações da Clever Leaves no Alentejo por 1.4 milhões de euros
Álvaro Covões, fundador e CEO da agência promotora de espectáculos ‘Everything is New‘, que organiza um dos maiores festivais de...


ICBC regressa a Berlin a 16 e 17 de Abril
É uma das maiores e mais reconhecidas conferências de B2B sobre canábis da Europa e regressa a Berlim já nos...


A legalização da canábis na Alemanha vista pelos olhos do hacker que criou um mapa essencial
Um hacker de Koblenz, uma cidade do estado da Renânia-Palatinado, criou um mapa com os locais onde, a partir de...







