Saúde
Das Endocannabinoid-System in der Schwangerschaft
Veröffentlicht
3 Jahrenem
von
Soraia Tomás
Das Endocannabinoid-System (ESA) ist an mehreren Aspekten der menschlichen Fortpflanzung beteiligt und ist ein wichtiges Element bei der Entwicklung von Mechanismen, die mit dem Fortschreiten einer gesunden Schwangerschaft verbunden sind. Die Endocannabinoid-Signalübertragung unterliegt strenger Kontrolle, und jede Störung dieses Gleichgewichts kann die Ursache für ein Versagen des Fortpflanzungsprozesses sein. Cannabis enthält Phytocannabinoide, die ECS modulieren, und es ist mehr Forschung erforderlich, die sich auf die Auswirkungen konzentriert, die Phytocannabinoide durch ihre Wirkung auf Cannabinoidrezeptoren auf Fruchtbarkeit, Schwangerschaftsausgang und fötale Gesundheit haben.
Als Schwangerschaft bezeichnet man den Schwangerschaftszeitraum des Menschen mit etwa neun Monaten, gerechnet von der Befruchtung und Einnistung einer Eizelle in die Gebärmutter bis zur Geburt. Während der Schwangerschaft durchläuft der mütterliche Organismus mehrere physiologische Veränderungen, die das heranwachsende Baby unterstützen und auf die Geburt vorbereiten. Eine Schwangerschaft beginnt mit der Befruchtung einer Eizelle (weiblicher Gamet) durch ein Spermium (männlicher Gamet).
Beim Menschen beginnt die Embryogenese oder Embryonalperiode mit der Befruchtung und dauert bis zum Beginn der fötalen Periode an. Nach der Befruchtung bewegt sich die Zygote langsam entlang des Eileiters in Richtung Gebärmutter. Im Laufe dieser mehr als einwöchigen Reise teilt sich die Zygote in identische Zellen. Diese Zellteilung beginnt etwa 24 bis 36 Stunden nach der Befruchtung. Am Ende des 4. Tages der Zellteilung entsteht aus der Zygote eine feste Kugel aus 16 oder 32 Zellen, die Morula genannt wird. Beim Erreichen der Gebärmutter, fünf Tage nach der Befruchtung, verändert sich die Morula und wird nun Blastozyste genannt. Anschließend löst sich die Proteinhülle der Blastozyste auf, wodurch ihre Trophoblastzellen mit den Endometriumzellen der Uteruswand in Kontakt treten und an diesen haften können. Der Embryo verbindet sich mit dem Endometrium durch einen Prozess namens Einnistung, der acht bis zehn Tage nach dem Eisprung stattfindet.
Während der vierten Schwangerschaftswoche (zweite Woche des Embryonalalters) dringen die Trophoblastzellen, die die Embryonalzellen umgeben, tief in die Gebärmutterschleimhaut ein und bilden die Plazenta und die Embryonalmembranen. In diesem Stadium wächst der Embryo schnell und die wichtigsten äußeren Merkmale nehmen Gestalt an. Dieser Prozess, der als Zelldifferenzierung bezeichnet wird, produziert die verschiedenen Arten von Zellen im Körper.
Die Entwicklung des Embryos beginnt mit der Teilung der Eizelle in mehrere Zellen, und in diesem Stadium beginnen sich die meisten Organe zu bilden, von denen viele funktionsfähig sind. Ab der achten Schwangerschaftswoche wird der Embryo als Fötus bezeichnet und stellt bereits die menschliche Gestalt dar, die sich bis zur Geburt kontinuierlich weiterentwickeln wird. Die Entbindung erfolgt durchschnittlich etwa 38 Wochen nach der Befruchtung, was etwa 40 Wochen nach Beginn der letzten Monatsblutung entspricht.
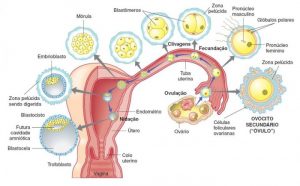
Foto: DR | biotadofuturo.com
Das Endocannabinoid-System und Schwangerschaft
Das Endocannabinoid-System (ESA) ist ein endogenes System, das in allen Wirbeltieren vorhanden ist und mit mehreren physiologischen Prozessen wie Appetitregulierung, Energie, Immunität [42] und Reproduktion [27] verbunden ist. Dieses System umfasst Cannabinoidrezeptoren, Endocannabinoide und Enzyme, die Endocannabinoide synthetisieren und metabolisieren.
Endocannabinoide sind Lipidmediatoren, die von mehrfach ungesättigten Fettsäureketten abgeleitet sind und die Fähigkeit haben, verschiedene Prozesse zu modulieren, einschließlich der Reproduktion von Säugetieren [58]. Sie werden „on demand“ aus Phospholipidvorläufern synthetisiert, die sich in der Plasmamembran von Zellen befinden [43]. Dieser Stoffwechsel führt zur Produktion von zwei endogenen Cannabinoiden, Anandamid (AEA) und 2-Arachidonoylglycerol (2-AG). Das erste Ziel von AEA und 2-AG sind Cannabinoidrezeptoren (CB1 und CB2) [42], die in peripheren Geweben exprimiert werden, an die sie koppeln und intrazelluläre Signalmechanismen aktivieren. Zusätzlich zu letzterem haben AEA und 2-AG auch Affinität zu den Rezeptoren GPR55, GPR119, Perixoma Proliferator-Activated Receptor (PPAR) und Transient Vanilloid Potential Receptor 1 (TRPV1).
Um die beabsichtigte Wirkung hervorzurufen, werden die Endocannabinoide AEA und 2-AG durch spezifische Enzyme, darunter Fettsäureamidhydrolase (FAAH) bzw. Monoacylglycerollipase (MAGL), oder durch Endozytose abgebaut.
Nicht nur die Endocannabinoide AEA und 2-AG, sondern auch andere Bestandteile von ECS sind entscheidend für eine erfolgreiche Befruchtung, Blastozystenentwicklung, Endometriumdezidualisierung, Plazentaentwicklung und Embryonenimplantation.
Das Endocannabinoid-System und das Fortpflanzungssystem
SEC wird in Uterus [37], Eierstöcken, Eileiter, Follikeln, Endometrium [29], Spermien und Hoden [36] exprimiert, mit spezifischen Zellorten und Veränderungen in seiner Expression als Reaktion auf eine Schwangerschaft.
Die Expression von SEC sowohl im weiblichen als auch im männlichen Fortpflanzungssystem (z. B. Leydig-Zellen*) beweist seine Beteiligung an lebenswichtigen physiologischen Prozessen wie Spermatogenese, Follikulogenese und Oozytenreifung. [28][35]
*Leydig-Zellen – Zellen in den Hodenkanälchen, die für die Produktion von Testosteron verantwortlich sind, wenn sie durch das luteinisierende Hormon (LH) stimuliert werden.
Es gibt wissenschaftliche Beweise, die die Hypothese der Regulation von SEC durch Sexualhormone stützen [26], die darauf hindeuten, dass Komponenten von SEC unter hormoneller Kontrolle sowohl in den Eierstöcken als auch im sich entwickelnden Follikel, im Corpus luteum und im Corpus albican exprimiert werden. [28]
Die Plasmaspiegel von AEA, FAAH und Progesteron variieren während des Menstruationszyklus [13][20][22][23]. Es wurde bewiesen, dass Progesteron, das vom Corpus luteum produziert wird, die SEC moduliert, indem es die Aktivität von FAAH potenziert, was zu einer Abnahme der AEA-Konzentration führt. [29][23][31][32]
Östrogen, das vom Ovarialfollikel während des Menstruationszyklus produziert wird, bindet an spezifische Östrogenrezeptoren, was zur Regulierung zahlreicher Signalmechanismen führt, die an Zellproliferation, Apoptose und Autophagie beteiligt sind [46]. Maya et al., legt nahe, dass Östrogen AEA- und Cannabinoidrezeptoren sowohl in der Uterusdrüse als auch im Lumen von Epithelzellen moduliert.[28]
Eierstöcke
Die erste Studie zur Lokalisation von ECS in den Eierstöcken wurde 2009 von El-Talina und Kollegen entwickelt [11]. Diese Studie zeigte die Expression von Cannabinoid-Rezeptoren, AEA, 2-AG, FAAH und MAGL in der Medulla und der Rinde des Eierstocks, vorwiegend in den Granulosazellen der Follikel, in den Thekazellen**, in den sekundären und tertiären Follikeln, im Corpus luteum und später im Albican-Körper [29].
**Thekazellen – somatische Zellen, die im sich entwickelnden Follikel vorhanden sind und außerhalb der Granulosazellschicht liegen. Wenn Follikel in der sekundären Entwicklungsphase aktiviert werden, werden Thekazellen zur Differenzierung rekrutiert. Wenn sie aktiv sind, produzieren diese Zellen Androgene, die während der Follikelreifung eine entscheidende Rolle spielen und den sich entwickelnden Follikel schützen, indem sie strukturelle und vaskuläre Unterstützung bis zum Eisprung bieten.
Eileiter
Präklinische Studien deuten darauf hin, dass AEA durch die Aktivierung von CB1-Rezeptoren einen angemessenen oviduktalen Spermientransport durch den Eileiter fördert. Beim Erreichen der Eizelle werden die Spermien zunehmend geringeren Konzentrationen von AEA ausgesetzt, die ideal für die Befruchtung und ausreichend für die Aktivierung des TRPV1-Rezeptors sind. [7]
Mehrere Autoren unterstützen die Hypothese, dass die Regulierung der Endocannabinoidsynthese eine Voraussetzung für eine erfolgreiche präembryonale Entwicklung ist. In diesen Studien wurde die Expression des CB1-Rezeptors im ersten Stadium von zwei embryonalen Zellen bis zur Entwicklung der Blastozyste nachgewiesen. In späteren Stadien ist dieser Ausdruck auf Trophektoderm beschränkt [38][59][55]
Die Konzentrationen von Endocannabinoiden tragen zur Schaffung einer geeigneten Umgebung für den Transport des Embryos vom Eierstock zur Gebärmutter bei, wo er implantiert wird. Tatsächlich wurde eine höhere Konzentration von FAAH in der Ampulle und von NAPE-PLD im Isthmus nachgewiesen. Dieses Expressionsdifferential ist für die Aufrechterhaltung angemessener AEA-Spiegel während des oviduktalen Transports verantwortlich. [7]
Gebärmutter
Das Endocannabinoid-System spielt eine Schlüsselrolle im Uterus [37] und beeinflusst dessen Empfänglichkeit, Plazentaentwicklung und Embryoimplantation [3][12][21][30][33][44][48]
Der Uterus erfährt während der Schwangerschaft morphologische und physiologische Veränderungen, um seinen Erfolg sicherzustellen, wobei Apoptose und sekundäre Nekrose wichtige Mechanismen sind, die an der Rückbildung von Plazentazellen beteiligt sind. [53][56] [61]
Eine erfolgreiche Embryonenimplantation ist auf ein präzises Zusammenspiel zwischen Endometrium und der zu implantierenden Blastozyste angewiesen. Es erfordert zunächst ein aufnahmefähiges Uterusmilieu und später eine aktive Blastozyste, die in der Lage ist, den Uterus zu erreichen und implantiert zu werden. [36][41][57] Dieser Prozess findet 6 bis 7 Tage nach der Befruchtung statt und für seinen Beginn wird eine Blastozyste benötigt, die aus der Zona pellucida austreten kann, wodurch der Trophoblast freigelegt wird, gefolgt von seinem Eintritt in das Endometrium und schließlich seine Invasion [36].
uterine Empfänglichkeit
Präklinische Studien deuten darauf hin, dass die Empfänglichkeit des Uterus entscheidend von der Aktivität von AEA, FAAH und dem Leukämie-Inhibitorfaktor (LIF) beeinflusst wird, einem Mitglied der IL-6-Familie, das das Zellwachstum durch Hemmung der Zelldifferenzierung beeinflusst. [9][18][48][49][57]
Embryonale Implantation
Niedrige Konzentrationen von AEA und hohe Konzentrationen von FAAH werden zum Zeitpunkt der Implantation festgestellt, im Vergleich zu anderen Standorten im gleichen Zeitraum, die viel höhere Konzentrationen von AEA und niedrige Konzentrationen von FAAH aufweisen.
Diese Aussage wird durch vorklinische Studien verglichen, in denen der Embryo hohen Anandamidspiegeln im Uterus ausgesetzt war, was zu einer Intoxikation des Uterus, einer verminderten Proliferation von Trophoblastzellen und einem daraus resultierenden Implantationsversagen führte. [39][54]59]
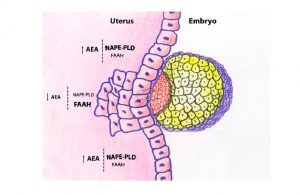
C. Fernandet al. Endocannabinoid-System und Schwangerschaft. Reproduktion (2016)
Studien, die an Frauen durchgeführt wurden, die sich einer In-vitro-Fertilisation unterziehen, bei denen es möglich ist, den Zeitpunkt der Einnistung genau zu bestimmen und die Embryonalentwicklung zu verfolgen, zeigten, dass anfänglich (kurzzeitig) ein Anstieg der Anandamid-Plasmaspiegel beobachtet wird (wahrscheinlich um das Schlüpfen der Blastozyste zu unterstützen), gefolgt von einer abrupten Verringerung dieser Spiegel (um die Apoptose von Trophoblastzellen zu verhindern und so eine angemessene Blastozystenfixierung und eine günstige embryonale Entwicklung sicherzustellen [12]. Niedrige AEA-Spiegel (und folglich hohe FAAH-Spiegel) sind erforderlich , das an den CB1-Rezeptor koppelt und den ERK-Signalweg aktiviert. In niedrigen Konzentrationen ist Anandamid in der Lage, die ERK-Signalübertragung zu aktivieren und das Blastozystenwachstum zu fördern, in hohen Konzentrationen hemmt es die Kalziummobilisierung [55].
Damit sich eine Schwangerschaft erfolgreich entwickeln kann, ist ein kritisches Gleichgewicht der Endocannabinoidspiegel erforderlich, um eine ordnungsgemäße Entwicklung der Trophoblastzellen und die Einnistung des Embryos sicherzustellen. [12] AEA moduliert die Synthese von COX-2, Entzündungsmediatoren, die die Gefäßpermeabilität und Angiogenese erhöhen, die der Embryoimplantation vorausgeht. [4][16]
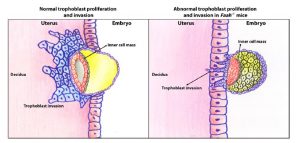
C. Fernandet al. Endocannabinoid-System und Schwangerschaft. Reproduktion (2016)
plazentare Entwicklung
Die Entwicklung der Plazenta umfasst streng kontrollierte Prozesse der Proliferation, Differenzierung und Apoptose trophoblastischer Zellen durch das Zusammenspiel von Hormonen, Wachstumsfaktoren und anderen Signaltransduktoren. Die SEC spielt eine Schlüsselrolle in den Mechanismen, die der Entwicklung der Plazenta zugrunde liegen, und eine Deregulierung dieses Gleichgewichts ist mit Veränderungen im Verlauf einer gesunden Schwangerschaft verbunden. [zwei]
Die normale Entwicklung der Plazenta hängt von der Differenzierung und Invasion des Trophoblasten ab, dem wichtigsten zellulären Bestandteil der Plazenta, der in der Frühschwangerschaft aus dem Trophektoderm der Blastozyste stammt. Während dieses Prozesses der Entwicklung und Invasion vermehren sich Trophoblastzellen, um die Schnittstelle zwischen dem mütterlichen Körper und dem Embryo zu bilden. Trophoblastzellen dringen in die Decidua ein, so dass sich die Uterusarterien günstig entwickeln, was die Expansion von extraembryonalem Gewebe und einen erhöhten Blutfluss zur Plazenta und zum sich entwickelnden Fötus ermöglicht. Jede Störung dieses streng regulierten und von vielen Faktoren beeinflussten Prozesses kann zu Schwangerschaftskomplikationen führen. [49]
Die Endocannabinoide, AEA und 2-AG modulieren das Netzwerk von Zytokinen und Hormonen, die in den Mechanismen vorhanden sind, die der Entwicklung der Plazenta innewohnen. [1][2][52] Paria et al. deuten darauf hin, dass Trophoblastzellen, die niedrigen Konzentrationen von Endocannabinoiden ausgesetzt sind, schneller wachsen und sich differenzieren [38][39][40][41] und diese Wirkungen durch CB1-Rezeptoren vermittelt werden.
Studien zeigen, dass Cannabinoidrezeptoren und AEA in dezidualen Zellen exprimiert werden [16][5] – spezialisierte Plazentazellen, zu denen Trophoblast, Zytotrophoblast und Synzytiotrophoblast gehören. [47][19]
AEA unterbricht den Dezidualisierungsprozess in Primärkulturen von Endometriumzellen von Ratten, was auf die Inkompatibilität hoher AEA-Konzentrationen und erfolgreicher Blastozystenimplantation und Überleben hindeutet. [16]
Darüber hinaus wurde gezeigt, dass die hemmende Rolle von AEA im Dezidualisierungsprozess die Aktivität von CYP19A1 verringert, dem Gen, das für die Codierung von Aromatase verantwortlich ist, einem Enzym, das am Prozess der Umwandlung von Androgen in Östrogen beteiligt ist [8] und die Sekretion von humanem Choriongonadotropin beeinträchtigt durch den Synzytiotrophoblasten. [8]
Studien zeigen auch, dass die Veränderung des AEA-Stoffwechsels die Zelldifferenzierung beeinflusst und eine Blockierung des Zellzyklus in der G2/M-Phase induziert sowie die Marker Prolaktin (PRL) und Wachstumsfaktor (IGFBP1) auf rezeptorabhängige Weise verändert.CB1 im endothelialen Stroma Zellen und in Primärkulturen von aus der Plazenta stammenden dezidualen Fibroblasten (HdF)-Zellen. [1]
Die fetale Exposition gegenüber toxischen Substanzen kann zu Entwicklungsveränderungen, Geburtsfehlern und Frühgeburten führen. Die Plazenta schützt den Fötus vor der Exposition gegenüber diesen Substanzen, indem sie xenobiotische Efflux-Transporter verwendet, die das Eindringen dieser Giftstoffe verhindern. Das Brustkrebs-Resistenzprotein (BCRP/ABCG2) ist ein solcher Efflux-Transporter, der in der Plazenta die Exposition des Fötus gegenüber bestimmten Giftstoffen begrenzt. [47]
Die Synzytiotrophoblasten entstehen aus der Fusion von Zytotrophoblasten, einem Prozess, der durch die AEA reguliert wird, die über den CB2-Rezeptor (vermittelt durch cAMP) auch die Aktivität des Efflux-Transporters BCRP / ABCG2 moduliert, der in der Membran der Plazenta-Syncytiotrophoblasten exprimiert wird, und so die Fötus vor Exposition gegenüber toxischen Komponenten. [47]
Es wurde auch gezeigt, dass das Endocannabinoid 2-AG eine wichtige Rolle bei der Entwicklung der Plazenta spielt, indem es durch die Aktivierung des CB2-Rezeptors die Apoptose von Zytotrophoblastenzellen induziert. Das Vorhandensein von zwei Schlüsselenzymen, die an der Biosynthese und dem Abbau von 2-AG, DAGLA und MAGL, in Zytotrophoblastenzellen beteiligt sind, ermöglicht eine angemessene Regulierung der 2-AG-Spiegel in situ. [7] [2]
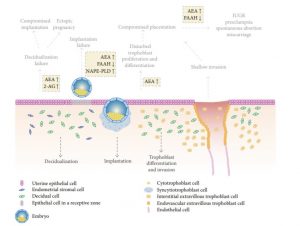
Fonseca, BM et al. (2013). Das Endocannabinoid-System in der Postimplantationsphase: Eine Rolle während der Dezidualisierung und Plazentation. International
Lieferung
Die Reifung des Gebärmutterhalses ist eine Voraussetzung für normale Wehen, während derer der unflexible Gebärmutterhals weniger starr werden und sich erweitern muss. Dies impliziert eine dramatische Umgestaltung der extrazellulären Matrix. Studien deuten auf das Vorhandensein des TRPV1-Rezeptors bei der Umgestaltung der extrazellulären Matrix hin, die kurz vor der Entbindung im Gebärmutterhals auftritt. TRPV1-IR-Nervenfasern wurden während der Reifung des Gebärmutterhalses nachgewiesen, was auf ihre Schlüsselrolle bei der Nozizeption hinweist, die den mit der Geburt verbundenen Schmerzmechanismen innewohnt. [63]
Prostaglandine sind Lipidmoleküle, die eine grundlegende Rolle in den Mechanismen spielen, die mit dem Einsetzen der Geburt verbunden sind, da sie an der Regulierung der Uteruskontraktionen, der Zervixreifung und des Membranbruchs beteiligt sind. Eine Studie von Mitchell et al. im Jahr 2008 legt nahe, dass hohe Konzentrationen von AEA die Produktion von Prostaglandinen erhöhen, die die mit dem Einsetzen der Wehen verbundenen Uteruskontraktionen stimulieren. [33]
Die AEA-Spiegel während der Schwangerschaft wurden ebenfalls quantifiziert, und es wurde der Schluss gezogen, dass die Konzentrationen dieser Komponente im ersten Trimester niedriger waren (ähnlich wie die während der Lutealphase des Menstruationszyklus bewerteten Werte), wobei diese Werte bis zum Beginn von beibehalten wurden im dritten Trimester, Quartal, als sie zu steigen begannen. Zu Beginn der Wehen sind diese Werte 2- bis 4-mal höher als im ersten Trimester. [20][22][34]
Eine an Ratten durchgeführte präklinische Studie zeigte, dass die Expression von CB1-, CB2- und TRPV1-Rezeptoren im Decidua-Gewebe (gebildet aus der Endometriumschicht, die die Blastozyste nach der Einnistung bedeckt – dem Prozess der Anheftung an die Uteruswand) entsprechend mit variiert ein vorhersehbares Muster. [14] Gleichzeitig steigen die AEA- und PEA-Spiegel an zwei bestimmten Punkten in der Schwangerschaft an, Tag 10 und Tag 19, wenn die Vorbereitung auf die Entbindung beginnt. Diese Beobachtungen deuten darauf hin, dass das Endocannabinoid-System nicht nur mit der richtigen Entwicklung einer Schwangerschaft, sondern auch mit dem Zeitpunkt der Vorbereitung auf die Geburt eng verflochten ist. [14]
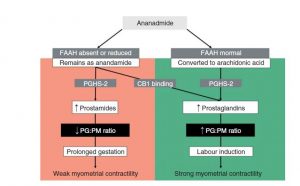
C. Hsiu-Wen et al. Die Rolle von Endocannabinoiden in der Schwangerschaft (2013)
Cannabis und Schwangerschaft
Cannabis enthält Phytocannabinoide, die das Endocannabinoid-System modulieren, und es sind weitere Untersuchungen erforderlich, die sich auf die Auswirkungen konzentrieren, die Phytocannabinoide durch ihre Wirkung auf Cannabinoidrezeptoren auf die Fruchtbarkeit, den Schwangerschaftsausgang und die Gesundheit des Fötus haben. Eine Veränderung der Cannabinoid-Rezeptor-Expression oder der Endocannabinoid-Homöostase durch übermäßigen Cannabiskonsum während der Schwangerschaft ist mit negativen Schwangerschaftsergebnissen verbunden, einschließlich Frühgeburt, Fehlgeburt, geplatzter Plazenta, Babys mit niedrigem Geburtsgewicht. Laut einigen Autoren wird bei Cannabiskonsumenten eine Zunahme der männlichen und weiblichen Unfruchtbarkeit beobachtet [60], während andere dieser Aussage widersprechen. [62].
Im Jahr 2020 deutet eine systematische Überprüfung, die von Forschern der Columbia University, des New York State Psychiatric Institute und der Swinburne University durchgeführt wurde, darauf hin, dass keine statistisch signifikanten Unterschiede bei Kindern gefunden werden, die Cannabis während der Schwangerschaft ausgesetzt sind, und kommt zu dem Schluss, dass eine pränatale Exposition gegenüber der Pflanze Cannabis nicht damit verbunden ist mit einem kognitiven Defizit bei diesen Kindern. [64]
In diesem Dokument konzentrieren wir uns auf die wichtige Rolle, die das Endocannabinoid-System beim Fortschreiten der Schwangerschaft spielt, und nicht auf das therapeutische Potenzial der Cannabispflanze. Aus ethischen Gründen werden klinische Studien dieser Art nicht an schwangeren Frauen durchgeführt, daher ist die Cannabinoidtherapie Situationen vorbehalten, in denen der Nutzen die mit seiner Verwendung verbundenen Risiken überwiegt, wie z von anderen Arzneimitteln (mit potenziellen Nebenwirkungen) angezeigt war.
Andernfalls wird die Verwendung von Cannabinoiden während der Schwangerschaft nicht empfohlen.

Foto DR| der Wissenschaftler
Fazit
Das Endocannabinoid-System (SEC) ist an mehreren Aspekten der menschlichen Fortpflanzung beteiligt und ist ein wichtiges Element bei der Entwicklung von Mechanismen, die mit dem Fortschreiten einer gesunden Schwangerschaft verbunden sind. Das Endocannabinoid 2-AG ist an der Entwicklung der ersten Stadien der embryonalen Zelle durch die Aktivierung von CB2-Rezeptoren beteiligt, während die AEA-Spiegel bis zum Zeitpunkt der Geburt tendenziell niedrig sind und dann dramatisch ansteigen. Das FAAH-Enzym spielt eine Schlüsselrolle bei der ECS-Modulation während der Schwangerschaft. Bisherige wissenschaftliche Untersuchungen belegen die Bedeutung dieses Systems bei der Regulierung der Befruchtung durch Spermienaktivierung, Oozytenreifung, Embryoschlüpfen, Eireifung, Eileitertransport, Embryoimplantation, Plazentaentwicklung, Aufrechterhaltung der Schwangerschaft und Wehen.
Die Endocannabinoid-Signalübertragung unterliegt einer so strengen Kontrolle, dass jede Störung dieses Gleichgewichts die Ursache für ein Versagen des Fortpflanzungsprozesses sein kann. Angesichts der Zunahme des Cannabiskonsums bei Erwachsenen in vielen Ländern ist es wichtig, die Folgen für die männliche/weibliche Fruchtbarkeit und während der gesamten Schwangerschaft zu verstehen. Das therapeutische Potenzial dieser vielseitigen Pflanze ist Situationen vorbehalten, in denen die Vorteile ihrer Anwendung die Risiken einer erfolgreichen Schwangerschaft überwiegen. Die medizinische Nachsorge ist entscheidend für eine sichere und wirksame Behandlung mit Cannabinoiden.
Bibliographie:
- Almada M., Amaral C., Diniz-da-Costa M., Correia-da-Silva G., Teixeira NA und Fonseca BM. Das Endocannabinoid Anandamid beeinträchtigt die In-vitro-Dezidualisierung menschlicher Zellen. Reproduktion 152: 351-361, 2016.
- Almada M, Costa L, Fonseca B, Alves P, Braga J, Gonçalves D, Teixeira N und Correia-da-Silva G. Das Endocannabinoid 2-Arachidonoylglycerol fördert den Stress des endoplasmatischen Retikulums in Plazentazellen. Reproduktion 160: 171-180, 2020.
- Battista N., Bari M., Rapino C., Trasatti F., D'Agostino A., Maccarrone M. Regulierung der weiblichen Fruchtbarkeit durch das Endocannabinoid-System. Hum Fertil 2007;10:207–16.
- Bariani MV, Domínguez Rubio AP, Cella M, Burdet J, Franchi AM und Aisemberg J. Rolle des Endocannabinoid-Systems in den Mechanismen, die an LPS-induzierten vorzeitigen Wehen beteiligt sind. Reproduktion 150: 463-472, 2015.
- Brocato B, Zoerner AA, Janjetovic Z, Skobowiat C, Gupta S, Moore BM, 2. Platz, Slominski A, Zhang J, Schenone M, Phinehas R, Ferry RJ, Jr., Dick E, Jr., Hubbard GB, Mari G, und Schlabritz-Loutsevitch N. Endocannabinoid-Crosstalk zwischen Plazenta und mütterlichem Fett in einem Pavianmodell (Papio spp.) von Fettleibigkeit. Plazenta 34: 983-989, 2013.
- Braun AJ. Neuartige Cannabinoid-Rezeptoren. Br J Pharmacol 152: 567-575, 2007.
- Costa MA, Fonseca BM, Keating E, Teixeira NA und Correia-da-Silva G. 2-Arachidonoylglycerol-Effekte in Zytotrophoblasten: Stoffwechselenzymexpression und Apoptose in BeWo-Zellen. Reproduktion 147: 301-311, 2014.
- Costa MA, Keating E, Fonseca BM, Teixeira NA und Correia-da-Silva G. 2-Arachidonoylglycerol beeinträchtigt die Synzytialisierung menschlicher Zytotrophoblastzellen: Einfluss der Endocannabinoid-Signalübertragung auf die Plazentaentwicklung. Mol Cell Endocrinol 399: 386-394, 2015.
- Cui N, Wang C, Zhao Z, Zhang J, Xu Y, Yang Y und Hao G. Die Rolle von Anandamid, Fettsäureamidhydrolase und Leukämie-Hemmfaktor auf dem Endometrium während des Implantationsfensters. Front Endocrinol 8: 268, 2017. Endocannabinoide in der Frühschwangerschaft
- Domenico E, Todaro 306 F, Rossi G, Dolci S, Geremia R, Rossi P und Grimaldi P. Ein überaktiver Typ-2-Cannabinoidrezeptor induziert Meiose in fötalen Keimdrüsen und beeinträchtigt die ovarielle Reserve. ZelltodDis 8: e3085, 2017.
- El-Talatini MR, Taylor AH, Elson JC, Brown L, Davidson AC und Konje JC. Lokalisation und Funktion des Endocannabinoid-Systems im menschlichen Eierstock. PLoS One 4: e4579, 2009.
- El-Talatini MR, Taylor AH, Konje JC. Schwankungen der Anandamidspiegel vom Eisprung bis zur frühen Schwangerschaft In-vitro-Fertilisation-Embryotransfer-Frauen und ihre hormonelle Regulation. Hum Reprod 2009;24:1989–98.
- El-Talatini MR, Taylor AH, Konje JC. Die Beziehung zwischen Plasmaspiegeln von Endocannabinoid, Anandamid, Sexualsteroiden und Gonadotropinen während des Menstruationszyklus. Fertil Steril 2009; Im Druck, doi:10.1016/j.fertnStert.1008.12.033.
- Fonseca BM, Correia-da-Silva G, Taylor AH, Konje JC, Bell SC, Teixeira NA. Raumzeitliche Expressionsmuster von Anandamid-bindenden Rezeptoren an Rattenimplantationsstellen: Beweise für eine Rolle des Endocannabinoidsystems während der Zeit der Plazentaentwicklung. Am J Obstet Gynecol 2009;7:121.
- Fonseca BM, Correia-da-Silva G, Teixeira NA. Anandamid-induzierter Zelltod: Zweifache Wirkung in primären dezidualen Zellkulturen von Ratten. Plazenta 2009;30:686–92.
- Fonseca BM, Correia-da-Silva G und Teixeira NA. Anandamid schränkt die Differenzierung des Uterusstromas ein und ist entscheidend für die vollständige Dezidualisierung. Mol Cell Endocrinol 411: 167-176, 2015.
- Garcia-Arencibia M, Molina-Holgado E und Molina-Holgado F. Wirkung der Endocannabinoid-Signalübertragung auf das Zellschicksal: Leben, Tod, Differenzierung und Proliferation von Gehirnzellen. Br J Pharmacol 176:1361-1369, 2019.
- Habayeb OM, Bell SC, Konje JC. Endogene Cannabinoide: Metabolismus und ihre Rolle bei der Fortpflanzung. Life Science 2002;70:1963–77.
- Habayeb OM, Taylor AH, Bell SC, Taylor DJ und Konje JC. Expression des Endocannabinoid-Systems in der menschlichen Plazenta im ersten Trimester und ihre Rolle bei der Proliferation von Trophoblasten. Endocrinol 149: 5052-5060, 2008.
- Habayeb OM, Taylor AH, Evans MD, et al. Plasmaspiegel des Endocannabinoids Anandamid bei Frauen – eine potenzielle Rolle bei der Aufrechterhaltung der Schwangerschaft und der Wehen? J Clin Endocrinol Metab 2004;89:5482–7.
- Horne AW, Phillips 3rd JA, Kane N, et al. Die CB1-Expression ist im Eileiter und in der Dezidua von Frauen mit Eileiterschwangerschaft abgeschwächt. PLoS One 2008;3:e3969.
- Lam PM, Marczylo TH, El-Talatini M, et al. Ultra-Performance-Flüssigkeitschromatographie-Tandem-Massenspektrometrie-Methode zur Messung von Anandamid in menschlichem Plasma. Anal Biochem 2008;380:195–201.
- Lazzarin N., Valensise H., Bari M. et al. Schwankungen der Fettsäureamidhydrolase- und Anandamidspiegel während des menschlichen Ovulationszyklus. Gynecol Endocrinol 2004;18:212–8.
- Li Y, Bian F, Sun X und Dey SK. Mäuse, denen Cnr1 und Cnr2 fehlen, zeigen Implantationsdefekte. Endocrinol 160: 938-946, 2019.
- López-Cardona AP, Pérez-Cerezales S, Fernández-González R, Laguna-Barraza R, Pericuesta E, Agirregoitia N, Gutiérrez-Adán A und Agirregoitia E. Akt- und MAPK-Signalwege. FASEB J 1: 3-31, 3372.
- MacCarrone M, De Felici M, Bari M, Klinger F, Siracusa G und Finazzi-Agrò A. Down-regulation of anandamide hydrolase in mouse uterus by sexual hormones. Euro J Biochem 267: 2991-2997, 2000.
- Maccarrone M, Valensise H, Bari M, Lazzarin N, Romanini C und Finazzi-Agrò A. Progesteron reguliert Anandamidhydrolase in menschlichen Lymphozyten hoch: Rolle von Zytokinen und Implikationen für J Immunol 166: 7183-7189, 2001.
- Maia J, Almada M, Silva A, Correia-da-Silva G, Teixeira N, Sá SI und Fonseca BM. Die Expression des Endocannabinoidsystems im weiblichen Fortpflanzungstrakt wird durch Östrogen moduliert. J Steroid Biochem Mole Biol 174: 40-47, 2017. Endocannabinoide in der Frühschwangerschaft
- Maia J, Fonseca BM, Teixeira N und Correia-da-Silva G. Die grundlegende Rolle des Endocannabinoid-Systems in Endometrium und Plazenta: Auswirkungen auf pathophysiologische Aspekte von Uterus- und Schwangerschaftsstörungen. Menschliche Reproduktion Update 26: 586-602, 2020.
- Maccarrone M. Endocannabinoide: Freunde und Feinde der Fortpflanzung. Prog Lipid Res 2009;48:344–54.
- Maccarrone M, Bari M, Di Rienzo M, Finazzi-Agro A, Rossi A. Progesteron aktiviert den Promotor der Fettsäureamidhydrolase (FAAH) in menschlichen T-Lymphozyten durch den Transkriptionsfaktor Ikaros. Hinweise auf eine synergistische Wirkung von Leptin. J. Biol. Chem. 2003; 278: 32726–32.
- Maccarrone M, Valensise H, Bari M, Lazzarin N, Romanini C, Finazzi-Agro A. Progesteron reguliert die Anandamidhydrolase in menschlichen Lymphozyten hoch: Rolle von Zytokinen und Auswirkungen auf die Fruchtbarkeit. J Immunol 2001;166:7183–9.
- Mitchell MD, Sato TA, Wang A, Keelan JA, Ponnampalam AP, Glass M. Cannabinoide stimulieren die Prostaglandinproduktion durch menschliches Schwangerschaftsgewebe durch einen gewebe- und CB1-Rezeptor-spezifischen Mechanismus. Am J Physiol Endocrinol Metab 2008;294:E352–6.
- Nallendran V, Lam PM, McParland PC, Taylor AH, Konje JC. Vorhersage vorzeitiger Wehen bei asymptomatischen Hochrisikopatientinnen anhand von Anandamidspiegeln im Plasma. Reproduziert Sci 2009;16:220ª
- Nielsen JE, Rolland AD, Rajpert-De Meyts E, Janfelt C, Jørgensen A, Winge SB, Kristensen DM, Juul A, Chalmel F, Jégou B und Skakkebaek NE. Charakterisierung und Lokalisierung der Endocannabinoid-Systemkomponenten im erwachsenen menschlichen Hoden. Sci Rep 9: 12866, 2019.
- Norwitz ER, Schust DJ, Fisher SJ. Implantation und das Überleben der frühen Schwangerschaft. New Engl J Med 2001;345:1400–8.
- Pagano E, Orlando P, Finizio S, Rossi A, Buono L, Iannotti FA, Piscitelli F, Izzo AA, Di Marzo V und Borrelli F. Rolle des Endocannabinoidsystems bei der Kontrolle der Kontraktilität des Mausmyometriums während des Menstruationszyklus. Biochem Pharmacol. 124: 83-93, 2017.
- Paria BC, Das SK & Dey SK 1995 Der Mausembryo vor der Implantation ist ein Ziel für die Cannabinoid-Liganden-Rezeptor-Signalübertragung. PNAS 92 9460–9464. (doi:10.1073/pnas.92.21.9460)
- Paria BC, Dey SK. Ligand-Rezeptor-Signalisierung mit Endocannabinoiden in der Präimplantations-Embryonenentwicklung und -Implantation. Chem Phys Lipids 2000;108: 211–20.
- Paria BC, Ma W, Andrenyak DM, et al. Die Wirkungen von Cannabinoiden auf die Präimplantationsentwicklung und Implantation von Mausembryos werden durch Cannabinoidrezeptoren vom Gehirntyp vermittelt. Biol Reprod 1998;58:1490–5.
- Paria BC, Wang H, Dey SK. Endocannabinoid-Signalisierung bei der Synchronisierung der Embryonalentwicklung und der Empfänglichkeit des Uterus für die Implantation. Chem Phys Lipids 2002;121:201–10.
- Pertwee RG. Endocannabinoide und ihre pharmakologischen Wirkungen. Handb Exp Pharmacol 231: 1-37, 2015.
- Piomelli D, Giuffrida A, Calignano A und Rodríguez de Fonseca F. Das Endocannabinoid-System als Ziel für Therapeutika. Trends Pharmacol Sci 21: 218-224, 2000.
- Ribeiro ML, Vercelli CA, Sordelli MS, et al. 17beta-Östradiol und Progesteron regulieren die Anandamidsynthese im Rattenuterus. Reproduktion Biomed Online 2009;18: 209–18.
- Schmid PC, Paria BC, Krebsbach RJ, Schmid HH, Dey SK. Veränderungen der Anandamidspiegel im Uterus der Maus sind mit der Empfänglichkeit des Uterus für die Embryoimplantation verbunden. Proc Natl Acad Sci USA 1997;94:4188–92.
- Shrivastava A, Kuzontkoski PM, Groopman JE und Prasad A. Cannabidiol induziert den programmierten Zelltod in Brustkrebszellen, indem es die Wechselwirkung zwischen Apoptose und Autophagie koordiniert. Mol Cancer Therapeut 10: 1161-1172, 2011.
- Szilagyi JT, Composto-Wahler GM, Joseph LB, Wang B, Rosen T, Laskin JD und Aleksunes LM. Anandamid reguliert die plazentare Transporterexpression durch CB2-Rezeptor-vermittelte Hemmung der cAMP-Synthese herunter. Pharmacol Res 141: 331-342, 2019.
- Sonne X, Dey SK. Aspekte der Endocannabinoid-Signalgebung in der Periimplantationsbiologie. Mol Cell Endocrinol 2008;286:S3–S11.
- Taylor AH, Ang C, Bell SC, Konje JC. Die Rolle des Endocannabinoid-Systems bei Gametogenese, Implantation und Frühschwangerschaft. Hum Reprod Update 2007;13: 501–13.
- Trabucco E., Acone G., Marenna A. et al. Endocannabinoid-System in der Plazenta im ersten Trimester: niedrige FAAH- und hohe CB1-Expression charakterisieren spontane Fehlgeburten. Plazenta 2009;30:516–22.
- Tranguch S, Daikoku T, Guo Y, Wang H, Dey SK. Cell Mol Life Sci 2005;62:1964–73
- Vaswani K., Chan HW, Peiris HN, Nitert MD, Bradley RJ, Armitage JA, Rice GE und Mitchell MD. Gestationsbezogene Genexpression des Endocannabinoid-Signalwegs in Rattenplazenta. Med Inflamm 2015: 850471, 2015.
- Vercelli CA, Aisemberg J, Billi S, Wolfson ML, Franchi AM. Das Endocannabinoid-System und Stickstoffmonoxid sind an den schädlichen Wirkungen von Lipopolysaccharid auf murine Decidua beteiligt. Plazenta 2009;30:579–84.
- Wang H, Dey SK. Lipidsignalisierung bei der Embryoimplantation. Prostaglandine Other Lipid Mediat 2005;77:84–102.
- Wang H, Matsumoto H, Guo Y, Paria BC, Roberts RL, Dey SK. Die differentielle G-Protein-gekoppelte Cannabinoidrezeptor-Signalgebung durch Anandamid lenkt die Blastozystenaktivierung für die Implantation. Proc Natl Acad Sci USA 2003;100:14914–9.(doi:10.1073/pnas.2436379100)
- Wang H., Xie H., Sun X, et al. Differentielle Regulierung der Endocannabinoid-Synthese und des Abbaus im Uterus während der Embryo-Implantation. Prostaglandine Other Lipid Mediat 2007;83:62–74.
- Wang H, Dey SK, Maccarrone M. Jekyll und Hyde: zwei Gesichter der Cannabinoid-Signalisierung bei männlicher und weiblicher Fruchtbarkeit. Endocr Rev 2006;27:427–48.
- Wolfson ML, Muzzio DO, Ehrhardt J, Franchi AM, Zygmunt M und Jensen F. Expressionsanalyse der Cannabinoidrezeptoren 1 und 2 in B-Zellen während der Schwangerschaft und ihre Rolle bei der Zytokinproduktion. J Reprod Immunol 116: 23-27, 2016.
- Yang ZM, Paria BC, Dey SK. 1996 Die Aktivierung von Cannabinoid-Rezeptoren des Gehirntyps stört die Präimplantations-Embryonenentwicklung von Mäusen. Biol. Reprod. 1996; 55: 756-61. doi:10.1095/biolreprod55.4.756
- Zuckerman B, Frank DA, Hingson R, et al. Auswirkungen des mütterlichen Marihuana- und Kokainkonsums auf das fötale Wachstum. N. Engl. J. Med. 1989; 320: 762-8.
- López-Cardona, I. Ibarra-Lecue, R. Laguna-Barraza, S. Pérez-Cerezales, L.Urigüen, N. Agirregoitia, A. Gutierrez-Adán, E. Agirregoitia, Wirkung einer chronischen THC-Verabreichung in den Fortpflanzungsorganen von männliche Mäuse, Spermatozoen und In-vitro-Fertilisation, Biochemical Pharmacology (2018), doi: https://doi.org/10.1016/j.bcp.2018.07.045
- Hsiu-Wen et al. Die Rolle von Endocannabinoiden in der Schwangerschaft – Reproduktion (2013) 146 R101–R109 https://doi.org/10.1530/REP-12-0508
- Tingaker BK, Ekman-Ordeberg G., Facer P., Irestedt L., Anand P. Einfluss von Schwangerschaft und Wehen auf das Auftreten von Nervenfasern, die den Capsaicinrezeptor TRPV1 im menschlichen Corpus und Cervix uteri exprimieren. abspielen biol. Endokrinol. 2008;6:8. doi: 10.1186/1477-7827-6
- Torres CA, Medina-Kirchner C, O'Malley KY und Hart CL (2020) Die Gesamtheit der Beweise deutet darauf hin, dass eine vorgeburtliche Cannabisexposition nicht zu kognitiven Beeinträchtigungen führt: eine systematische und kritische Überprüfung. Vorderseite. Psychol. 11: 816. doi: 10.3389 / fpsyg.2020.00816
__________________________________________________________________*Soraia Tomás ist Krankenschwester und hat 2015 ihren Abschluss an der Escola Superior de Enfermagem de Coimbra gemacht. Sie arbeitete auf der Intensivstation für Herz-Thorax-Chirurgie und Lungentransplantation in Lissabon. Derzeit arbeitet er im Spine Center, einem Wirbelsäulenchirurgiedienst und einer Intensivstation für allgemeine Chirurgie im Hospital da Luz in Coimbra, der Stadt, in der er lebt. Begeistert vom Bereich medizinisches Cannabis, ist er Mitglied des wissenschaftlichen Rates des portugiesischen Observatoriums für medizinisches Cannabis, nahm an Konferenzen in diesem Bereich teil (unter anderem Portugal Medical Cannabis, Cannabis Europa, CannX) und erwarb einen postgradualen Abschluss in GMPs für Medizinisches Cannabis, Kurs, der vom portugiesischen Observatorium für medizinisches Cannabis in Zusammenarbeit mit dem Militärlabor für chemische und pharmazeutische Produkte und der Fakultät für Pharmazie der Universität Lissabon durchgeführt wird. Präsident des Vorstands von Acanna – Portugiesischer Verband für Informationen über Cannabis, beabsichtigt, Projekte zu entwickeln, die der Verbreitung, Aufklärung und Schulung von medizinischem Cannabis für Angehörige der Gesundheitsberufe und die breite Öffentlichkeit gewidmet sind, um so Exzellenz in der beruflichen Praxis und einen sicheren und effektiven Zugang zu Cannabinoiden zu fördern Therapien.
____________________________________________________________________________________________________
[Haftungsausschluss: Bitte beachten Sie, dass dieser Text ursprünglich auf Portugiesisch verfasst wurde und mit einem automatischen Übersetzer ins Englische und andere Sprachen übersetzt wird. Einige Wörter können vom Original abweichen und in anderen Sprachen können Tippfehler oder Fehler auftreten.]____________________________________________________________________________________________________

Was macht man mit 3 € im Monat? Werden Sie einer unserer Förderer! Wenn Sie glauben, dass unabhängiger Cannabis-Journalismus notwendig ist, abonnieren Sie eine der Ebenen von unser Patreon-Konto und Sie haben Zugang zu einzigartigen Geschenken und exklusiven Inhalten. Wenn wir viele sind, können wir mit wenig etwas bewirken!
Soraia Tomás, die 2015 ihren Abschluss in Krankenpflege an der Escola Superior de Enfermagem de Coimbra machte, arbeitete auf der Intensivstation für Herz-Thorax-Chirurgie und Lungentransplantation in Lissabon. Derzeit arbeitet er im Spine Center, einem Wirbelsäulenchirurgiedienst und einer Intensivstation für allgemeine Chirurgie im Hospital da Luz in Coimbra, der Stadt, in der er lebt. Begeistert vom Bereich medizinisches Cannabis, ist er Mitglied des wissenschaftlichen Rates des portugiesischen Observatoriums für medizinisches Cannabis, nahm an Konferenzen in diesem Bereich teil (unter anderem Portugal Medical Cannabis, Cannabis Europa, CannX) und erwarb einen postgradualen Abschluss in GMPs für Medizinisches Cannabis, Kurs, der vom portugiesischen Observatorium für medizinisches Cannabis in Zusammenarbeit mit dem Militärlabor für chemische und pharmazeutische Produkte und der Fakultät für Pharmazie der Universität Lissabon durchgeführt wird. Der Präsident der Generaldirektion von APCNNA – Portugiesische Vereinigung für Informationen über Cannabis, beabsichtigt, Projekte zu entwickeln, die der Verbreitung, Bildung und Ausbildung von medizinischem Cannabis für Angehörige der Gesundheitsberufe und die breite Öffentlichkeit gewidmet sind, um so Exzellenz in der beruflichen Praxis und einen sicheren Zugang zu fördern. wirksam für Cannabinoid-Therapien.
-
Soraia Tomáshttps://cannareporter.eu/author/soraia/
-
Soraia Tomáshttps://cannareporter.eu/author/soraia/
-
Soraia Tomáshttps://cannareporter.eu/author/soraia/
-
Soraia Tomáshttps://cannareporter.eu/author/soraia/
Ähnliche Neuigkeiten
-


Die Flowr Corporation gibt die Registrierung von vier neuen Cannabissorten in mehreren Regionen bekannt und gibt ein Update zu ihren kanadischen Aktivitäten
-


USA: Safer Banking Act macht einen Schritt in Richtung finanzieller Freiheit für den Cannabissektor
-


USA: Der Kongress schätzt die Einnahmen auf 13,7 Milliarden US-Dollar, wenn Cannabis bundesweit entkriminalisiert wird
-


Wir haben Rainer's Reefer CBD Flowers getestet und waren positiv überrascht
-


Oregon: Der Rücktritt des Außenministers und des Stabschefs bringt Ethik und Unvereinbarkeiten zur Diskussion
-


Hongkong nimmt erste Festnahme wegen Besitzes von CBD-Produkten vor

Mais recentes


USA: DEA akzeptiert Empfehlung zur Neuklassifizierung von Cannabis
Die Drug Enforcement Administration (DEA) hat die Empfehlung des Department of Health and Human Services (HHS), einer Bundesbehörde der Bundesstaaten, angenommen...


Mila Jansen erklärt, warum sie mit 80 Jahren als Königin des Haschisch gilt: „Ich habe mein ganzes Leben lang Pflanzen angebaut“
Mila Jansen wurde 1944 in Liverpool geboren, wurde aber schon früh zur Weltbürgerin. Habe zum ersten Mal Cannabis probiert...


Álvaro Covões, der Land von Clever Leaves erworben hat, sagt, er habe „kein Interesse am Cannabisanbau“
Anfang April berichteten wir, dass Álvaro Covões, Gründer und CEO von „Everything is New“, das Grundstück, auf dem er ansässig war, gekauft hatte...


Portugals regulatorischer Vorteil in der Cannabisindustrie
In der dynamischen Landschaft des europäischen Cannabisanbaus hat sich Portugal zu einem vorläufigen Spitzenreiter entwickelt. Obwohl es viele natürliche Vorteile mit... teilt


ICBC Berlin glänzt wieder. Es ist der Beginn einer neuen Ära für die Cannabisindustrie in Deutschland
Die ICBC Berlin war die erste große internationale Cannabiskonferenz, die nach der Legalisierung des Konsums durch Erwachsene in... stattfand.


USA: Produkte von Mike Tyson wegen Schimmelbefall zurückgerufen
Die kalifornischen Behörden haben eine obligatorische Rückrufmitteilung für zwei Produkte der Cannabismarke Mike Tyson herausgegeben.


Es ist 4:20 Uhr und in Porto und Lissabon wird gefeiert
Der Termin zur Feier der Cannabiskultur rückt näher! Diesen Samstag, den 20. April, ist der Tag, an dem...


Paul Bergholts, mutmaßlicher Anführer von Juicy Fields, in der Dominikanischen Republik festgenommen
Paul Bergholts, der mutmaßliche Anführer des Juicy-Fields-Pyramidensystems, wurde in der Dominikanischen Republik festgenommen und wird ...


Cannabinoide zeigen vielversprechende Ergebnisse bei der Behandlung der Borderline-Persönlichkeitsstörung
Eine von Khiron LifeSciences durchgeführte und von Guillermo Moreno Sanz koordinierte Untersuchung legt nahe, dass Medikamente auf der Basis von...


Fall Juicy Fields: 9 von Europol und Eurojustice festgenommen. Betrug übersteigt 645 Millionen Euro
Eine gemeinsame Untersuchung mehrerer europäischer Behörden mit Unterstützung von Europol und Eurojust führte zur Festnahme von neun Verdächtigen ...







