Santé
Le système endocannabinoïde pendant la grossesse
Publié
il y a des années 3em
Par
Soraia Tomas
Le système endocannabinoïde (ESA) est impliqué dans plusieurs aspects inhérents à la reproduction humaine, étant un élément important dans le développement des mécanismes associés à la progression d'une grossesse saine. La signalisation endocannabinoïde est sous contrôle strict, et toute perturbation de cet équilibre peut être à l'origine d'un échec du processus de reproduction. Le cannabis contient des phytocannabinoïdes qui modulent l'ECS et des recherches supplémentaires sont nécessaires sur l'impact que les phytocannabinoïdes, par leur action sur les récepteurs cannabinoïdes, ont sur la fertilité, l'issue de la grossesse et la santé du fœtus.
La grossesse est la période de gestation des êtres humains d'environ neuf mois, à compter de la fécondation et de l'implantation d'un ovule dans l'utérus jusqu'à la naissance. Pendant la grossesse, l'organisme maternel subit plusieurs changements physiologiques qui soutiennent la croissance du bébé et le préparent à l'accouchement. Une grossesse commence par la fécondation d'un ovule (gamète femelle) par un spermatozoïde (gamète mâle).
Chez l'homme, l'embryogenèse, ou période embryonnaire, commence avec la fécondation et se poursuit jusqu'au début de la période fœtale. Après la fécondation, le zygote se déplace lentement le long de la trompe de Fallope vers l'utérus. Au cours de ce voyage de plus d'une semaine, le zygote se divise en cellules identiques. Cette division cellulaire commence environ 24 à 36 heures après la fécondation. A la fin du 4ème jour de division cellulaire, le zygote donne naissance à une sphère solide de 16 ou 32 cellules appelée morula. En atteignant l'utérus, cinq jours après la fécondation, la morula subit des modifications et s'appelle maintenant un blastocyste. Par la suite, l'enveloppe protéique du blastocyste se dissout, ce qui permet à ses cellules trophoblastiques d'entrer en contact et d'adhérer aux cellules endométriales de la paroi utérine. L'embryon s'unit à l'endomètre par un processus appelé nidation, qui a lieu huit à dix jours après l'ovulation.
Au cours de la quatrième semaine d'âge gestationnel (deuxième semaine d'âge embryonnaire), les cellules trophoblastiques qui entourent les cellules embryonnaires pénètrent profondément dans la muqueuse utérine, formant le placenta et les membranes embryonnaires. À ce stade, l'embryon se développe rapidement et les principales caractéristiques externes commencent à se dessiner. Ce processus, appelé différenciation cellulaire, produit les différents types de cellules dans le corps.
Le développement de l'embryon commence par la division de l'œuf en plusieurs cellules et c'est à ce stade que la plupart des organes commencent à se former, dont beaucoup sont fonctionnels. A partir de huit semaines d'âge gestationnel, l'embryon est appelé fœtus et présente déjà la forme humaine qui se développera continuellement jusqu'à la naissance. L'accouchement a lieu en moyenne environ 38 semaines après la fécondation, ce qui correspond à environ 40 semaines après le début des dernières menstruations.
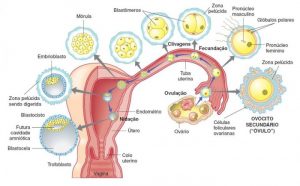
Photo : RD | biotadofuturo.com
Le système endocannabinoïde et la grossesse
Le système endocannabinoïde (ESA) est un système endogène, présent chez tous les vertébrés, qui est associé à plusieurs processus physiologiques tels que la régulation de l'appétit, l'énergie, l'immunité [42] et la reproduction [27]. Ce système implique des récepteurs cannabinoïdes, des endocannabinoïdes et des enzymes qui synthétisent et métabolisent les endocannabinoïdes.
Les endocannabinoïdes sont des médiateurs lipidiques, dérivés de chaînes d'acides gras polyinsaturés qui ont la capacité de moduler divers processus, y compris la reproduction des mammifères [58]. Ils sont synthétisés « à la demande » à partir de précurseurs phospholipidiques situés dans la membrane plasmique des cellules [43]. Ce métabolisme aboutit à la production de deux cannabinoïdes endogènes, l'anandamide (AEA) et le 2-arachidonoylglycérol (2-AG). La première cible de l'AEA et du 2-AG sont les récepteurs aux cannabinoïdes (CB1 et CB2) [42] exprimés dans les tissus périphériques, auxquels ils se couplent, activant les mécanismes de signalisation intracellulaires. En plus de ces derniers, l'AEA et le 2-AG ont également une affinité pour les récepteurs GPR55, GPR119, le récepteur activé par les proliférateurs du périxome (PPAR) et le récepteur potentiel vanilloïde transitoire 1 (TRPV1).
En produisant l'effet recherché, les endocannabinoïdes AEA et 2-AG sont dégradés par des enzymes spécifiques qui comprennent respectivement l'amide hydrolase d'acide gras (FAAH) et la monoacylglycérol lipase (MAGL), ou par endocytose.
Non seulement les endocannabinoïdes AEA et 2-AG, mais également d'autres composants de l'ECS sont cruciaux pour une fécondation réussie, le développement de blastocystes, la décidualisation de l'endomètre, le développement placentaire et l'implantation d'embryons.
Le système endocannabinoïde et le système reproducteur
La SEC est exprimée dans l'utérus [37], les ovaires, l'oviducte, les follicules, l'endomètre [29], le sperme et les testicules [36], avec des localisations cellulaires spécifiques et des modifications de son expression en réponse à la grossesse.
L'expression de SEC dans les systèmes reproducteurs féminin et masculin (par exemple, les cellules de Leydig*) prouve son implication dans des processus physiologiques vitaux tels que la spermatogenèse, la folliculogenèse et la maturation des ovocytes. [28][35]
*Cellules de Leydig – cellules situées dans les tubules séminifères, responsables de la production de testostérone lorsqu'elles sont stimulées par l'hormone lutéinisante (LH).
Il existe des preuves scientifiques soutenant l'hypothèse d'une régulation de la SEC par les hormones sexuelles [26] proposant que les composants de la SEC soient exprimés sous contrôle hormonal à la fois dans les ovaires et dans le follicule en développement, dans le corps jaune et dans le corps albican. [28]
Les taux plasmatiques d'AEA, de FAAH et de progestérone varient tout au long du cycle menstruel [13][20][22][23]. Il est prouvé que la progestérone, produite par le corps jaune, module le SEC en potentialisant l'activité du FAAH ce qui se traduit par une diminution de la concentration en AEA. [29][23][31][32]
Les œstrogènes, produits par le follicule ovarien au cours du cycle menstruel, se lient à des récepteurs spécifiques des œstrogènes, entraînant la régulation de nombreux mécanismes de signalisation impliqués dans la prolifération cellulaire, l'apoptose et l'autophagie [46]. Maya et al., suggère que les œstrogènes modulent les récepteurs AEA et cannabinoïdes dans la glande utérine et la lumière des cellules épithéliales.[28]
ovaires
La première étude de l'emplacement de l'ECS dans les ovaires a été développée en 2009 par El-Talatina et ses collègues [11]. Cette étude a révélé l'expression des récepteurs aux cannabinoïdes, AEA, 2-AG, FAAH et MAGL dans la moelle et le cortex de l'ovaire, principalement dans les cellules de la granulosa des follicules, dans les cellules de la thèque**, dans les follicules secondaires et tertiaires, dans le corps jaune et plus tard dans le corps albican [29].
** Cellules thèques - cellules somatiques présentes dans le follicule en développement qui se trouvent à l'extérieur de la couche de cellules de la granulosa. Lorsque les follicules sont activés dans la phase secondaire du développement, les cellules de la thèque sont recrutées pour se différencier. Lorsqu'elles sont actives, ces cellules produisent des androgènes qui jouent un rôle crucial pendant la maturation folliculaire et protègent le follicule en développement, fournissant un soutien structurel et vasculaire jusqu'à l'ovulation.
Trompes de Fallope
Des études précliniques suggèrent que l'AEA, en activant les récepteurs CB1, favorise un transport oviductal adéquat des spermatozoïdes à travers la trompe de Fallope. En atteignant l'ovule, les spermatozoïdes sont exposés à des concentrations progressivement plus faibles d'AEA, idéales pour la fécondation et suffisantes pour l'activation du récepteur TRPV1. [7]
Plusieurs auteurs soutiennent l'hypothèse selon laquelle la régulation de la synthèse des endocannabinoïdes est une exigence pour un développement pré-embryonnaire réussi. Dans ces études, l'expression du récepteur CB1 a été détectée dans le premier stade de deux cellules embryonnaires jusqu'au développement du blastocyste. Aux stades ultérieurs, cette expression est limitée au trophectoderme [38][59][55]
Les concentrations d'endocannabinoïdes contribuent à la création d'un environnement approprié pour le transport de l'embryon de l'ovaire à l'utérus, où il sera implanté. En fait, une concentration plus élevée de FAAH a été détectée dans l'ampoule et de NAPE-PLD dans l'isthme. Ce différentiel d'expression est responsable du maintien de niveaux adéquats d'AEA pendant le transport oviductal. [7]
utérus
Le système endocannabinoïde joue un rôle clé dans l'utérus [37], influençant sa réceptivité, le développement placentaire et l'implantation d'embryons [3][12][21][30][33][44][48]
L'utérus subit des changements morphologiques et physiologiques pendant la grossesse pour assurer son succès, l'apoptose et la nécrose secondaire étant des mécanismes importants impliqués dans la régression des cellules placentaires. [53][56] [61]
Pour réussir, l'implantation d'embryons dépend d'une interaction précise entre l'endomètre et le blastocyste à implanter. Il nécessite initialement un environnement utérin réceptif et plus tard un blastocyste actif capable d'atteindre l'utérus et de s'y implanter. [36][41][57] Ce processus se produit 6 à 7 jours après la fécondation et pour qu'il commence, un blastocyste capable d'émerger de la zone pellucide est nécessaire, exposant ainsi le trophoblaste, suivi de son entrée dans l'endomètre et enfin son invasion [36].
réceptivité utérine
Des études précliniques suggèrent que la réceptivité utérine est influencée de manière cruciale par l'activité de l'AEA, du FAAH et du facteur inhibiteur de la leucémie (LIF), un membre de la famille IL-6 qui affecte la croissance cellulaire en inhibant la différenciation cellulaire. [9][18][48][49][57]
Implantation Embryonnaire
De faibles concentrations d'AEA et des concentrations élevées de FAAH sont détectées au moment de l'implantation, par rapport à d'autres sites au cours de la même période, qui ont des niveaux beaucoup plus élevés d'AEA et de faibles niveaux de FAAH.
Cette déclaration est comparée par des études précliniques où l'embryon a été soumis à des niveaux élevés d'anandamide dans l'utérus, provoquant une intoxication de l'utérus, une diminution de la prolifération des cellules trophoblastiques et un échec d'implantation conséquent. [39][54]59]
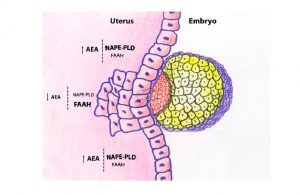
C. Fernand et al. Système endocannabinoïde et grossesse. Reproduction (2016)
Des études menées chez des femmes en fécondation in vitro, chez lesquelles il est possible d'identifier avec précision le moment de l'implantation ainsi que de suivre le développement embryonnaire, ont montré qu'on observe dans un premier temps une augmentation (pendant une courte période) des taux plasmatiques d'anandamide (probablement pour aider le blastocyste à éclore) suivie d'une réduction brutale de ces niveaux (pour empêcher l'apoptose des cellules du trophoblaste, assurant ainsi une fixation adéquate du blastocyste et un développement embryonnaire favorable [12]. De faibles niveaux d'AEA (et par conséquent des niveaux élevés de FAAH) sont nécessaires , qui se couple au récepteur CB1, activant la voie de signalisation ERK. À de faibles concentrations, l'anandamide est capable d'activer la signalisation ERK et de favoriser la croissance des blastocystes à des concentrations élevées inhibent la mobilisation du calcium [55].
Un équilibre critique des niveaux d'endocannabinoïdes est nécessaire pour que la grossesse se développe avec succès, assurant le bon développement des cellules trophoblastiques et l'implantation de l'embryon. [12] L'AEA module la synthèse de COX-2, des médiateurs inflammatoires qui augmentent la perméabilité vasculaire et l'angiogenèse qui précède l'implantation de l'embryon. [4][16]
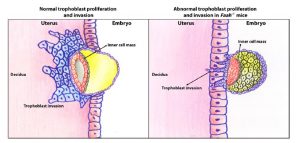
C. Fernand et al. Système endocannabinoïde et grossesse. Reproduction (2016)
développement placentaire
Le développement du placenta comprend des processus étroitement contrôlés de prolifération, de différenciation et d'apoptose des cellules trophoblastiques par l'interaction d'hormones, de facteurs de croissance et d'autres médiateurs de signalisation. Le SEC joue un rôle clé dans les mécanismes qui sous-tendent le développement du placenta et une dérégulation de cet équilibre est associée à des changements dans la progression d'une grossesse saine. [deux]
Le développement normal du placenta dépend de la différenciation et de l'invasion du trophoblaste, le principal composant cellulaire du placenta qui provient du trophectoderme du blastocyste en début de grossesse. Au cours de ce processus de développement et d'invasion, les cellules trophoblastiques se multiplient pour former l'interface entre le corps maternel et l'embryon. Les cellules trophoblastiques envahissent la caduque afin que les artères utérines se développent favorablement, permettant l'expansion des tissus extra-embryonnaires et l'augmentation du flux sanguin vers le placenta et le fœtus en développement. Toute perturbation de ce processus, étroitement régulé et influencé par de nombreux facteurs, peut entraîner des complications de la grossesse. [49]
Les endocannabinoïdes, AEA et 2-AG modulent le réseau de cytokines et d'hormones présentes dans les mécanismes inhérents au développement du placenta. [1][2][52] Paria et al. suggèrent que les cellules trophoblastiques exposées à de faibles niveaux d'endocannabinoïdes se développent et se différencient plus rapidement [38][39][40][41] et que ces effets sont médiés par les récepteurs CB1.
Des études montrent que les récepteurs cannabinoïdes et l'AEA sont exprimés dans les cellules déciduales [16][5] – des cellules placentaires spécialisées qui comprennent le trophoblaste, le cytotrophoblaste et le syncytiotrophoblaste. [47][19]
L'AEA perturbe le processus de décidualisation dans les cultures primaires de cellules endométriales de rat, suggérant l'incompatibilité des concentrations élevées d'AEA et l'implantation et la survie réussies des blastocystes. [16]
De plus, il a été démontré que le rôle inhibiteur de l'AEA dans le processus de décidualisation diminue l'activité du CYP19A1, le gène responsable du codage de l'aromatase, une enzyme impliquée dans le processus de conversion des androgènes en œstrogènes [8] et altère la sécrétion de la gonadotrophine chorionique humaine. par le syncytiotrophoblaste. [8]
Des études démontrent également que l'altération du métabolisme de l'AEA affecte la différenciation cellulaire et induit un blocage du cycle cellulaire dans la phase G2/M, ainsi que modifie les marqueurs de la prolactine (PRL) et du facteur de croissance (IGFBP1) de manière dépendante des récepteurs. cellules et dans des cultures primaires de cellules fibroblastes déciduales (HdF) dérivées du placenta. [1]
L'exposition du fœtus à des substances toxiques peut entraîner des changements de développement, des malformations congénitales et une naissance prématurée. Le placenta protège le fœtus de l'exposition à ces substances en utilisant des transporteurs d'efflux xénobiotiques qui empêchent l'invasion par ces substances toxiques. La protéine de résistance au cancer du sein (BCRP/ABCG2) est l'un de ces transporteurs d'efflux qui, dans le placenta, limite l'exposition du fœtus à certains toxiques. [47]
Les syncytiotrophoblastes sont issus de la fusion de cytotrophoblastes, un processus régulé par l'AEA, qui, via le récepteur CB2 (médié par l'AMPc), module également l'activité du transporteur d'efflux BCRP/ABCG2 exprimé dans la membrane des syncytiotrophoblastes placentaires, protégeant ainsi le foetus de l'exposition à des composants toxiques. [47]
L'endocannabinoïde 2-AG s'est également avéré être un acteur important dans le développement du placenta, induisant l'apoptose des cellules cytotrophoblastiques par l'activation du récepteur CB2. La présence de deux enzymes clés impliquées dans la biosynthèse et la dégradation du 2-AG, DAGLA et MAGL, dans les cellules cytotrophoblastiques, permet une régulation adéquate des niveaux de 2-AG sur place [7] [2]
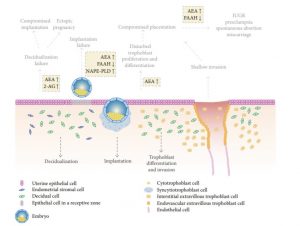
Fonseca, BM et al. (2013). Le système endocannabinoïde dans la période post-implantation : un rôle lors de la décidualisation et de la placentation. international
Livraison
La maturation du col de l'utérus est une condition préalable au travail normal, au cours de laquelle le col inflexible doit devenir moins rigide et se dilater. Cela implique un remodelage spectaculaire de la matrice extracellulaire. Des études suggèrent la présence du récepteur TRPV1 dans le remodelage de la matrice extracellulaire qui se produit dans le col de l'utérus quelques instants avant l'accouchement. Des fibres nerveuses TRPV1-IR ont été détectées au cours de la maturation du col de l'utérus, indiquant leur rôle clé dans la nociception inhérente aux mécanismes douloureux associés à l'accouchement. [63]
Les prostaglandines sont des molécules lipidiques qui jouent un rôle fondamental dans les mécanismes associés au début de la parturition, étant impliquées dans la régulation des contractions utérines, de la maturation cervicale et de la rupture des membranes. Une étude de Mitchell et al. en 2008 suggère que des concentrations élevées d'AEA augmentent la production de prostaglandines stimulant les contractions utérines associées au début du travail. [33]
Les niveaux d'AEA pendant la grossesse ont également été quantifiés et il a été conclu que les concentrations de ce composant étaient plus faibles au cours du premier trimestre (similaire aux niveaux évalués pendant la phase lutéale du cycle menstruel), en maintenant ces valeurs jusqu'au début de le troisième trimestre, quand ils ont commencé à augmenter. Au début du travail ces valeurs sont 2 à 4 fois plus élevées qu'au premier trimestre. [20][22][34]
Une étude préclinique menée chez le rat a montré que l'expression des récepteurs CB1, CB2 et TRPV1 varie dans le tissu caduque (formé de la couche d'endomètre qui recouvre le blastocyste après la nidation - le processus de fixation à la paroi utérine) selon avec un schéma prévisible. [14] Simultanément, les niveaux d'AEA et de PEA augmentent à deux moments spécifiques de la grossesse, le jour 10 et le jour 19, lorsque la préparation à l'accouchement commence. Ces observations indiquent que le système endocannabinoïde est intrinsèquement lié non seulement au bon développement de la grossesse, mais aussi au moment de la préparation à l'accouchement. [14]
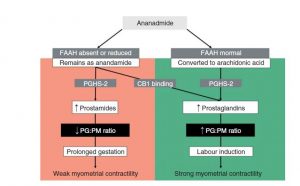
C. Hsiu-Wen et al. Le rôle des endocannabinoïdes pendant la grossesse (2013)
Cannabis et grossesse
Le cannabis contient des phytocannabinoïdes qui modulent le système endocannabinoïde et des recherches supplémentaires sont nécessaires sur l'impact que les phytocannabinoïdes, par leur action sur les récepteurs cannabinoïdes, ont sur la fertilité, l'issue de la grossesse et la santé du fœtus. L'altération de l'expression des récepteurs cannabinoïdes ou de l'homéostasie des endocannabinoïdes par une consommation excessive de cannabis pendant la grossesse est associée à des issues négatives de la grossesse, notamment une naissance prématurée, une fausse couche, une rupture du placenta, des bébés de faible poids à la naissance. Selon certains auteurs, une augmentation du taux d'infertilité masculine et féminine [60] est observée chez les consommateurs de cannabis, tandis que d'autres contredisent cette affirmation. [62].
En 2020, une revue systématique réalisée par des chercheurs de l'Université de Columbia, du New York State Psychiatric Institute et de l'Université de Swinburne suggère qu'aucune différence statistiquement significative n'est trouvée chez les enfants exposés au cannabis pendant la grossesse, concluant que l'exposition prénatale à la plante de cannabis n'est pas associée présentant un déficit cognitif chez ces enfants. [64]
Dans ce document, nous nous concentrons sur le rôle important que joue le système endocannabinoïde dans la progression de la grossesse plutôt que sur le potentiel thérapeutique de la plante de cannabis. Pour des raisons éthiques, les essais cliniques de cette nature ne sont pas menés chez les femmes enceintes, de sorte que la thérapie aux cannabinoïdes est réservée aux situations dans lesquelles les avantages l'emportent sur les risques associés à son utilisation, comme l'hyperémèse gravidique et le soulagement d'autres symptômes dans lesquels l'utilisation d'autres médicaments (avec des effets indésirables potentiels) a été indiqué.
Sinon, l'utilisation de cannabinoïdes pendant la grossesse n'est pas recommandée.

Photo RD| le scientifique
Conclusion
Le système endocannabinoïde (SEC) est impliqué dans plusieurs aspects inhérents à la reproduction humaine et est un élément important dans le développement des mécanismes associés à la progression d'une grossesse saine. L'endocannabinoïde 2-AG est impliqué dans le développement des premiers stades de la cellule embryonnaire par l'activation des récepteurs CB2, tandis que les niveaux d'AEA ont tendance à être bas jusqu'au moment de la parturition, où ils augmentent considérablement. L'enzyme FAAH joue un rôle clé dans la modulation de l'ECS pendant la grossesse. Jusqu'à présent, la recherche scientifique prouve l'importance de ce système dans la régulation de la fécondation par l'activation des spermatozoïdes, la maturation des ovocytes, l'éclosion des embryons, la maturation des ovules, le transport des oviductes, l'implantation des embryons, le développement du placenta, le maintien de la grossesse et le travail.
La signalisation endocannabinoïde est tellement contrôlée que toute perturbation de cet équilibre peut être à l'origine d'un échec du processus de reproduction. Avec une augmentation de la consommation de cannabis chez les adultes dans de nombreux pays, il est important de comprendre les conséquences sur la fertilité masculine/féminine et tout au long de la grossesse. Le potentiel thérapeutique de cette plante polyvalente est réservé aux situations où les bienfaits de son utilisation l'emportent sur les risques inhérents à une grossesse réussie. Le suivi médical est crucial pour que le traitement aux cannabinoïdes soit sûr et efficace.
Bibliographie:
- Almada M, Amaral C, Diniz-da-Costa M, Correia-da-Silva G, Teixeira NA et Fonseca BM. L'endocannabinoïde anandamide altère la décidualisation in vitro des cellules humaines. Reproduction 152 : 351-361, 2016.
- Almada M, Costa L, Fonseca B, Alves P, Braga J, Gonçalves D, Teixeira N et Correia-da-Silva G. L'endocannabinoïde 2-arachidonoylglycérol favorise le stress du réticulum endoplasmique dans les cellules placentaires. Reproduction 160 : 171‐180, 2020.
- Battista N, Bari M, Rapino C, Trasatti F, D'Agostino A, Maccarrone M. Régulation de la fertilité féminine par le système endocannabinoïde. Hum Fertil 2007;10:207–16.
- Bariani MV, Domínguez Rubio AP, Cella M, Burdet J, Franchi AM et Aisemberg J. Rôle du système endocannabinoïde dans les mécanismes impliqués dans le travail prématuré induit par le LPS. Reproduction 150 : 463-472, 2015.
- Brocato B, Zoerner AA, Janjetovic Z, Skobowiat C, Gupta S, Moore BM, 2nd, Slominski A, Zhang J, Schenone M, Phinehas R, Ferry RJ, Jr., Dick E, Jr., Hubbard GB, Mari G, et Schlabritz-Loutsevitch N. Diaphonie endocannabinoïde entre le placenta et la graisse maternelle dans un modèle de babouin (Papio spp.) d'obésité. Placenta 34 : 983-989, 2013.
- Brun AJ. Nouveaux récepteurs cannabinoïdes. Br J Pharmacol 152 : 567-575, 2007.
- Costa MA, Fonseca BM, Keating E, Teixeira NA et Correia-da-Silva G. Effets du 2-arachidonoylglycérol dans les cytotrophoblastes : expression des enzymes métaboliques et apoptose dans les cellules BeWo. Reproduction 147 : 301‐311, 2014.
- Costa MA, Keating E, Fonseca BM, Teixeira NA et Correia-da-Silva G. Le 2-arachidonoylglycérol altère la syncytialisation des cellules cytotrophoblastiques humaines : influence de la signalisation endocannabinoïde dans le développement placentaire. Mol Cell Endocrinol 399 : 386-394, 2015.
- Cui N, Wang C, Zhao Z, Zhang J, Xu Y, Yang Y et Hao G. Les rôles de l'anandamide, de l'hydrolase d'amide d'acide gras et du facteur inhibiteur de la leucémie sur l'endomètre pendant la fenêtre d'implantation. Front Endocrinol 8 : 268, 2017. Endocannabinoïdes en début de grossesse
- Domenico E, Todaro 306 F, Rossi G, Dolci S, Geremia R, Rossi P et Grimaldi P. Le récepteur cannabinoïde de type 2 hyperactif induit la méiose dans les gonades fœtales et altère la réserve ovarienne. Mort cellulaireDis 8 : e3085, 2017.
- El-Talatini MR, Taylor AH, Elson JC, Brown L, Davidson AC et Konje JC. Localisation et fonction du système endocannabinoïde dans l'ovaire humain. PLoS One 4 : e4579, 2009.
- El-Talatini MR, Taylor AH, Konje JC. Fluctuation des niveaux d'anandamide de l'ovulation au début de la grossesse fécondation in vitro-transfert d'embryons chez les femmes et sa régulation hormonale. HumReprod 2009;24:1989–98.
- El-Talatini MR, Taylor AH, Konje JC. La relation entre les niveaux plasmatiques de l'endocannabinoïde, de l'anandamide, des stéroïdes sexuels et des gonadotrophines au cours du cycle menstruel. Fertil Steril 2009; Sous presse, doi :10.1016/j.fertnStert.1008.12.033.
- Fonseca BM, Correia-da-Silva G, Taylor AH, Konje JC, Bell SC, Teixeira NA. Modèles d'expression spatio-temporelle des récepteurs de liaison à l'anandamide dans les sites d'implantation du rat : preuve d'un rôle du système endocannabinoïde pendant la période de développement placentaire. Am J Obstet Gynecol 2009;7:121.
- Fonseca BM, Correia-da-Silva G, Teixeira NA. Mort cellulaire induite par l'anandamide : effets doubles dans les cultures primaires de cellules déciduales de rat. Placenta 2009;30:686–92.
- Fonseca BM, Correia-da-Silva G et Teixeira NA. L'anandamide limite la différenciation stromale utérine et est essentiel pour une décidualisation complète. Mol Cell Endocrinol 411 : 167-176, 2015.
- Garcia-Arencibia M, Molina-Holgado E et Molina-Holgado F. Effet de la signalisation endocannabinoïde sur le destin cellulaire : vie, mort, différenciation et prolifération des cellules cérébrales. Br J Pharmacol 176:1361-1369, 2019.
- Habayeb OM, Bell SC, Konje JC. Cannabinoïdes endogènes : métabolisme et leur rôle dans la reproduction. Life Sci 2002;70:1963–77.
- Habayeb OM, Taylor AH, Bell SC, Taylor DJ et Konje JC. Expression du système endocannabinoïde dans le placenta humain du premier trimestre et son rôle dans la prolifération des trophoblastes. Endocrinol 149 : 5052-5060, 2008.
- Habayeb OM, Taylor AH, Evans MD, et al. Niveaux plasmatiques de l'endocannabinoïde anandamide chez les femmes - un rôle potentiel dans le maintien de la grossesse et le travail? J Clin Endocrinol Metab 2004;89:5482–7.
- Horne AW, Phillips 3rd JA, Kane N, et al. L'expression de CB1 est atténuée dans les trompes de Fallope et la caduque des femmes ayant une grossesse extra-utérine. PLoS One 2008;3:e3969.
- Lam PM, Marczylo TH, El-Talatini M, et al. Méthode de spectrométrie de masse en tandem par chromatographie liquide ultra performante pour la mesure de l'anandamide dans le plasma humain. Anal Biochem 2008;380:195–201.
- Lazzarin N, Valensise H, Bari M, et al. Fluctuations des taux d'hydrolase d'amide d'acide gras et d'anandamide au cours du cycle ovulatoire humain. Gynecol Endocrinol 2004;18:212–8.
- Li Y, Bian F, Sun X et Dey SK. Les souris manquant Cnr1 et Cnr2 présentent des défauts d'implantation. Endocrinol 160 : 938-946, 2019.
- López-Cardona AP, Pérez-Cerezales S, Fernández-González R, Laguna-Barraza R, Pericuesta E, Agirregoitia N, Gutiérrez-Adán A et Agirregoitia E. Le récepteur cannabinoïde CB(1) entraîne la maturation des ovocytes et le développement embryonnaire via PI3K/ Voies Akt et MAPK. FASEB J 31 : 3372-3382, 2017.
- MacCarrone M, De Felici M, Bari M, Klinger F, Siracusa G et Finazzi-Agrò A. Régulation à la baisse de l'anandamide hydrolase dans l'utérus de la souris par les hormones sexuelles. Euro J Biochem 267 : 2991-2997, 2000.
- Maccarrone M, Valensise H, Bari M, Lazzarin N, Romanini C et Finazzi-Agrò A. La progestérone régule à la hausse l'anandamide hydrolase dans les lymphocytes humains : rôle des cytokines et implications pour J Immunol 166 : 7183-7189, 2001.
- Maia J, Almada M, Silva A, Correia-da-Silva G, Teixeira N, Sá SI et Fonseca BM. L'expression du système endocannabinoïde dans l'appareil reproducteur féminin est modulée par les œstrogènes. J Steroid Biochem Mole Biol 174 : 40-47, 2017. Endocannabinoïdes en début de grossesse
- Maia J, Fonseca BM, Teixeira N et Correia-da-Silva G. Le rôle fondamental du système endocannabinoïde dans l'endomètre et le placenta : implications dans les aspects physiopathologiques des troubles de l'utérus et de la grossesse. Mise à jour de la reproduction humaine 26 : 586-602, 2020.
- Maccarrone M. Endocannabinoïdes : amis et ennemis de la reproduction. Prog Lipid Res 2009;48:344–54.
- Maccarrone M, Bari M, Di Rienzo M, Finazzi-Agro A, Rossi A. La progestérone active le promoteur de l'hydrolase des amides d'acides gras (FAAH) dans les lymphocytes T humains via le facteur de transcription Ikaros. Preuve d'un effet synergique de la leptine. J Biol Chem 2003;278:32726–32.
- Maccarrone M, Valensise H, Bari M, Lazzarin N, Romanini C, Finazzi-Agro A. La progestérone régule à la hausse l'anandamide hydrolase dans les lymphocytes humains : rôle des cytokines et implications pour la fertilité. J Immunol 2001;166:7183–9.
- Mitchell MD, Sato TA, Wang A, Keelan JA, Ponnampalam AP, Glass M. Les cannabinoïdes stimulent la production de prostaglandines par les tissus gestationnels humains grâce à un mécanisme spécifique aux tissus et aux récepteurs CB1. Am J Physiol Endocrinol Metab 2008;294:E352–6.
- Nallendran V, Lam PM, McParland PC, Taylor AH, Konje JC. Prédiction du travail prématuré chez les patients asymptomatiques à haut risque en utilisant les taux plasmatiques d'anandamide. Reproduit Sci 2009;16:220ª
- Nielsen JE, Rolland AD, Rajpert-De Meyts E, Janfelt C, Jørgensen A, Winge SB, Kristensen DM, Juul A, Chalmel F, Jégou B et Skakkebaek NE. Caractérisation et localisation des composants du système endocannabinoïde dans le testicule humain adulte. Sci Rep 9 : 12866, 2019.
- Norwitz ER, Schust DJ, Fisher SJ. Implantation et survie des grossesses précoces. New Engl J Med 2001;345:1400–8.
- Pagano E, Orlando P, Finizio S, Rossi A, Buono L, Iannotti FA, Piscitelli F, Izzo AA, Di Marzo V et Borrelli F. Rôle du système endocannabinoïde dans le contrôle de la contractilité du myomètre de la souris pendant le cycle menstruel. Biochem Pharmacol 124 : 83-93, 2017.
- Paria BC, Das SK & Dey SK 1995 L'embryon de souris préimplantatoire est une cible pour la signalisation des récepteurs ligands cannabinoïdes. PNAS 92 9460–9464. (doi : 10.1073/pnas.92.21.9460)
- Paria BC, Dey SK. Signalisation ligand-récepteur avec des endocannabinoïdes dans le développement et l'implantation de l'embryon préimplantatoire. Chem Phys Lipids 2000;108 : 211–20.
- Paria BC, Ma W, Andrenyak DM, et al. Les effets des cannabinoïdes sur le développement et l'implantation préimplantatoires des embryons de souris sont médiés par les récepteurs cannabinoïdes de type cérébral. Biol Reprod 1998;58:1490–5.
- Paria BC, Wang H, Dey SK. Signalisation endocannabinoïde dans la synchronisation du développement embryonnaire et de la réceptivité utérine pour l'implantation. Chem Phys Lipids 2002;121:201–10.
- Pertwee RG. Les endocannabinoïdes et leurs actions pharmacologiques. Handb Exp Pharmacol 231 : 1-37, 2015.
- Piomelli D, Giuffrida A, Calignano A et Rodríguez de Fonseca F. Le système endocannabinoïde comme cible pour les médicaments thérapeutiques. Trends Pharmacol Sci 21 : 218-224, 2000.
- Ribeiro ML, Vercelli CA, Sordelli MS, et al. Le 17bêta-oestradiol et la progestérone régulent la synthèse d'anandamide dans l'utérus du rat. Reprod Biomed Online 2009;18 : 209–18.
- Schmid PC, Paria BC, Krebsbach RJ, Schmid HH, Dey SK. Les changements dans les niveaux d'anandamide dans l'utérus de souris sont associés à la réceptivité utérine pour l'implantation d'embryons. Proc Natl Acad Sci USA 1997;94:4188–92.
- Shrivastava A, Kuzontkoski PM, Groopman JE et Prasad A. Le cannabidiol induit la mort cellulaire programmée dans les cellules cancéreuses du sein en coordonnant l'interaction entre l'apoptose et l'autophagie. Mol Cancer Therapeut 10 : 1161-1172, 2011.
- Szilagyi JT, Composto-Wahler GM, Joseph LB, Wang B, Rosen T, Laskin JD et Aleksunes LM. L'anandamide régule à la baisse l'expression du transporteur placentaire par l'inhibition médiée par le récepteur CB2 de la synthèse de l'AMPc. Pharmacol Res 141 : 331-342, 2019.
- Soleil X, Dey SK. Aspects de la signalisation endocannabinoïde en biologie péri-implantatoire. Mol Cell Endocrinol 2008;286:S3–S11.
- Taylor AH, Ang C, Bell SC, Konje JC. Le rôle du système endocannabinoïde dans la gamétogenèse, l'implantation et le début de la grossesse. Mise à jour Hum Reprod 2007;13 : 501–13.
- Trabucco E, Acone G, Marenna A, et al. Système endocannabinoïde dans le placenta du premier trimestre : une faible expression de FAAH et une expression élevée de CB1 caractérisent une fausse couche spontanée. Placenta 2009;30:516–22.
- Tranguch S, Daikoku T, Guo Y, Wang H, Dey SK. Complexité moléculaire inétablissant la réceptivité et l'implantation utérines. Cell Mol Life Sci 2005; 62: 1964–73
- Vaswani K, Chan HW, Peiris HN, Nitert MD, Bradley RJ, Armitage JA, Rice GE et Mitchell MD. Expression génique liée à la gestation de la voie des endocannabinoïdes dans le placenta de rat. Med Inflamm 2015 : 850471, 2015.
- Vercelli CA, Aisemberg J, Billi S, Wolfson ML, Franchi AM. Le système endocannabinoïde et l'oxyde nitrique sont impliqués dans les effets délétères du lipopolysaccharide sur la caduque murine. Placenta 2009;30:579–84.
- Wang H, Dey SK. Signalisation lipidique dans l'implantation d'embryons. Prostaglandines Other Lipid Mediat 2005;77:84–102.
- Wang H, Matsumoto H, Guo Y, Paria BC, Roberts RL, Dey SK. La signalisation différentielle des récepteurs cannabinoïdes couplés aux protéines G par l'anandamide dirige l'activation du blastocyste pour l'implantation. Proc Natl Acad Sci USA 2003;100:14914–9.(doi:10.1073/pnas.2436379100)
- Wang H, Xie H, Sun X, et al. Régulation différentielle de la synthèse et de la dégradation des endocannabinoïdes dans l'utérus lors de l'implantation de l'embryon. Prostaglandines Other Lipid Mediat 2007;83:62–74.
- Wang H, Dey SK, Maccarrone M. Jekyll et hyde : deux visages de la signalisation cannabinoïde dans la fertilité masculine et féminine. Endocr Rev 2006;27:427–48.
- Wolfson ML, Muzzio DO, Ehrhardt J, Franchi AM, Zygmunt M et Jensen F. Analyse de l'expression des récepteurs cannabinoïdes 1 et 2 dans les cellules B pendant la grossesse et leur rôle sur la production de cytokines. J. Reprod Immunol 116 : 23-27, 2016.
- Yang ZM, Paria BC, Dey SK. 1996 L'activation des récepteurs cannabinoïdes de type cérébral interfère avec le développement préimplantatoire de l'embryon de souris. Biol Reprod 1996;55:756-61. doi:10.1095/biolreprod55.4.756
- Zuckerman B, Frank DA, Hingson R, et al. Effets de la consommation maternelle de marijuana et de cocaïne sur la croissance fœtale. N Engl J Med 1989;320:762-8.
- López-Cardona, I. Ibarra-Lecue, R. Laguna-Barraza, S. Pérez-Cerezales, L.Urigüen, N. Agirregoitia, A. Gutierrez-Adán, E. Agirregoitia, Effet de l'administration chronique de THC dans les organes reproducteurs de souris mâles, spermatozoïdes et fécondation in vitro, Pharmacologie biochimique (2018), doi : https://doi.org/10.1016/j.bcp.2018.07.045
- Hsiu-Wen et al. Le rôle des endocannabinoïdes dans la grossesse – Reproduction (2013) 146 R101–R109 https://doi.org/10.1530/REP-12-0508
- Tingaker BK, Ekman-Ordeberg G., Facer P., Irestedt L., Anand P. Influence de la grossesse et du travail sur la présence de fibres nerveuses exprimant le récepteur de la capsaïcine TRPV1 dans le corps humain et le col de l'utérus. joue Biol. Endocrinol. 2008;6:8. doi: 10.1186/1477-7827-6
- Torres CA, Medina-Kirchner C, O'Malley KY et Hart CL (2020) La totalité des preuves suggèrent que l'exposition prénatale au cannabis n'entraîne pas de déficience cognitive : une revue systématique et critique. Devant. Psychol. 11 : 816. doi : 10.3389 / fpsyg.2020.00816
__________________________________________________________________*Soraia Tomás est infirmière, diplômée de l'Escola Superior de Enfermagem de Coimbra en 2015. Elle a travaillé en soins intensifs de chirurgie cardio-thoracique et de transplantation pulmonaire à Lisbonne. Il travaille actuellement au Spine Center, un service de chirurgie de la colonne vertébrale et une unité de soins intensifs de chirurgie générale à l'hôpital da Luz de Coimbra, la ville où il réside. Enthousiaste dans le domaine du cannabis médicinal, il est membre du conseil scientifique de l'Observatoire portugais du cannabis médicinal, a assisté à des conférences dans ce domaine (Portugal Medical Cannabis, Cannabis Europa, CannX, entre autres) et a obtenu un diplôme de troisième cycle en GMP pour Cannabis Médicinal, cours réalisé par l'Observatoire Portugais du Cannabis Médicinal en partenariat avec le Laboratoire Militaire des Produits Chimiques et Pharmaceutiques et la Faculté de Pharmacie de l'Université de Lisbonne. Président du conseil d'administration d'Apcanna - Association portugaise d'information sur le cannabis, a l'intention de développer des projets dédiés à la diffusion, à l'éducation et à la formation au cannabis médical auprès des professionnels de la santé et du grand public, favorisant ainsi l'excellence dans la pratique professionnelle et un accès sûr et efficace aux cannabinoïdes thérapies.
____________________________________________________________________________________________________
[Avertissement : veuillez noter que ce texte a été initialement rédigé en portugais et est traduit en anglais et dans d'autres langues à l'aide d'un traducteur automatique. Certains mots peuvent différer de l'original et des fautes de frappe ou des erreurs peuvent survenir dans d'autres langues.]____________________________________________________________________________________________________

Que faire avec 3€ par mois ? Devenez l'un de nos mécènes ! Si vous pensez qu'un journalisme indépendant sur le cannabis est nécessaire, abonnez-vous à l'un des niveaux de notre compte Patreon et vous aurez accès à des cadeaux uniques et du contenu exclusif. Si nous sommes nombreux, nous pouvons faire la différence avec peu !
Nouvelles connexes
-


Cannabis ou chanvre ? L'Espagne fait-elle les mêmes erreurs que le Portugal ?
-


Le Vanuatu veut produire du cannabis médical et du chanvre industriel
-


Thaïlande : Les médecins appellent à l'arrêt immédiat de la consommation de cannabis à des fins récréatives
-


La fusion d'Aphria et de Tilray crée la plus grande entreprise de cannabis au monde
-


Ethan Russo préside le conseil scientifique d'Endocanna Health
-


Liste de lecture du cannabis : #2 – Peter Tosh – « Légalisez-le »

Mais RECENTES


Álvaro Covões, qui a acquis des terres auprès de Clever Leaves, déclare qu'il n'a « aucun intérêt à cultiver du cannabis »
Début avril, nous avons annoncé qu'Álvaro Covões, fondateur et PDG de « Everything is New », avait acheté le terrain où il se trouvait...


L'avantage réglementaire du Portugal dans l'industrie du cannabis
Dans le paysage dynamique de la culture européenne du cannabis, le Portugal est devenu un leader intérimaire. Bien qu'il partage de nombreux avantages naturels avec...


ICBC Berlin brille à nouveau. C'est le début d'une nouvelle ère pour l'industrie du cannabis en Allemagne
ICBC Berlin a été la première grande conférence internationale sur le cannabis à avoir lieu après la légalisation de la consommation par les adultes en...


USA : Rappel de produits Mike Tyson pour contamination par des moisissures
Les autorités californiennes ont émis un avis de rappel obligatoire pour deux produits de la marque de cannabis de Mike Tyson,...


4h20 approche et il y a des célébrations à Porto et à Lisbonne
La date de célébration de la culture du cannabis approche ! Ce samedi 20 avril, c'est le jour où...


Paul Bergholts, chef présumé de Juicy Fields, arrêté en République dominicaine
Paul Bergholts, le chef présumé du système pyramidal Juicy Fields, a été arrêté en République dominicaine et sera soumis à...


Les cannabinoïdes révèlent des résultats prometteurs dans le traitement du trouble de la personnalité limite
Une enquête menée par Khiron LifeSciences et coordonnée par Guillermo Moreno Sanz suggère que les médicaments à base de...


Affaire Juicy Fields : 9 détenus par Europol et Eurojustice. L'arnaque dépasse les 645 millions d'euros
Une enquête conjointe menée par plusieurs autorités européennes, soutenues par Europol et Eurojust, a abouti à l'arrestation de neuf suspects...


Les consommateurs réguliers de cannabis peuvent avoir besoin de plus d'anesthésie pendant les procédures médicales
Les consommateurs réguliers de cannabis peuvent avoir besoin de plus d'anesthésie pendant les procédures médicales pour rester sous sédation que...


L’avenir du CBD au Japon : comment les réformes juridiques façonneront le marché
À la fin de l'année dernière, le Japon a fait un grand pas vers la réforme du cannabis après avoir approuvé...







